题目内容
14.下列图示的说明或判断正确的是( )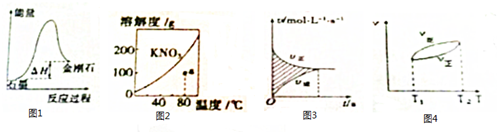
| A. | 由图1可知,从能量角度考虑,金刚石比石墨更稳定 | |
| B. | 图2中a点降温后加入KNO3 固体都能转变成饱和溶液 | |
| C. | 图3中阴影部分的面积表示△v=v正-v逆 | |
| D. | 由图4可知,正反应△H>0 |
分析 A、物质具有的能量越低越稳定;
B、由图2可知,KNO3 的溶解度随温度升高而增大,a点处于不饱和状态,可以通过减低温度或者减小溶质的量转变成饱和溶液;
C、由图3可知,横坐标与纵坐标乘积为浓度的变化,据此分析;
D、由图4可知,升温平衡向逆反应方向移动;
解答 解:A、由图1可知,石墨的能量低于金刚石,所以石墨比金刚石稳定,故A错误;
B、由图2可知,KNO3 的溶解度随温度升高而增大,a点处于不饱和状态,降温后可以转变成饱和溶液或者加入KNO3 固体也能转变成饱和溶液,故B正确;
C、由图3可知,横坐标与纵坐标乘积为浓度的变化,所以阴影部分的面积表示△c=c正-c逆,故C错误;
D、由图4可知,升温平衡向逆反应方向移动,所以正反应△H<0,故D错误.
故选B.
点评 本题考查了化学平衡图象、阅读题目获取信息的能力等,难度中等,需要学生具备运用信息与基础知识分析问题、解决问题的能力.

练习册系列答案
相关题目
4.下列描述正确的是( )
| A. | 氯气、SO2都能使品红溶液褪色,它们的漂白原理相同 | |
| B. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存 | |
| C. | 某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42- | |
| D. | Fe(NO3)2溶液中滴加少量稀硫酸会变黄色 |
5.将一定浓度的碘酸钾溶液和亚硫酸氢钠溶液混合,发生反应:2KIO3+6NaHSO3═2KI+3Na2SO4+3H2SO4.实验发现:开始反应缓慢,随后反应速率“急增”,最后又逐渐减小.下列有关化学反应速率“急增”的解释合理的是( )
| A. | c(IO3-)、c(HSO3-)逐渐增大 | B. | c(K+)逐渐增大,反应速率加快 | ||
| C. | 溶液的pH减小,IO3-的氧化性增强 | D. | c(H+)增大,反应速率加快 |
9.下列溶液中与1L 0.1mol•L-1 NaCl溶液混合,所得中c(Cl-)最大的是( )
| A. | 50mL 1mol•L-1 NaCl溶液 | B. | 20mL 2mol•L-1 AlCl3溶液 | ||
| C. | 30mL 1mol•L-1 MgCl2溶液 | D. | 100mL 3mol•L-1 NaClO3溶液 |
19.水溶液中能大量共存的一组离子是( )
| A. | NH4+、Ba2+、Br-、CO32- | B. | Cl-、SO32-、Fe2+、H+ | ||
| C. | K+、Na+、SO42-、MnO4- | D. | Na+、H+、NO3-、HCO3- |
3.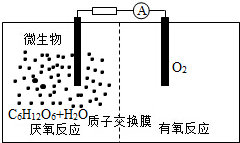 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 正极反应中有CO2生成 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从负极区移向正极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |
4.下列说法正确的是( )
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸.如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较低温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |