题目内容
【题目】溴是一种重的化工原料,从淡化海水中提取溴的工艺流程如下:
![]()
⑴操作Ⅱ中,用饱和Na2CO3碱性溶液吸收Br2,过程中有CO2产生,反应的粒子方程式为______,当0.6 mol Br2被吸收时,转移电子的数目为______
![]() 步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有______
步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有______![]() 填序号
填序号![]()
a.烧杯 b.分液漏斗c.普通漏斗 d.玻璃棒 e.蒸发皿 f.冷凝管
![]() 某化学兴趣小组利用高锰酸钾和浓盐酸反应制取氯气,并探究氯水的性质
某化学兴趣小组利用高锰酸钾和浓盐酸反应制取氯气,并探究氯水的性质
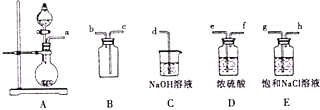
①将A,B,C相连,制得Cl2后加入适量水,即可制得氯水,将所得氯水分为两份,进行甲,乙两个实验,实验操作如下,将现象填入下表:
实验序号 | 实验操作 | 现象 |
甲 | 将氯水滴入品红溶液 | ______ |
乙 | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 |
②由实验乙不能推出氯气与水反应的产物具有酸性,原因是______,若要制备纯净干燥的Cl2,按气流方向连接各仪器接口,顺序为a→_____→_____→_____→_____→_____→_____→d
![]() 实验完毕后,假设装置C中氢氧化钠和
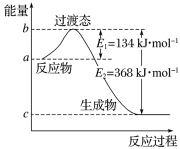
实验完毕后,假设装置C中氢氧化钠和![]() 恰好完全反应,其反应方程式为______,反应后溶液中离子浓度由大到小的顺序为______,常温下HClO的电离平衡常数为K,则常温下NaClO水解反应的平衡常数为______(用含Ka和Kw的表达式表示)
恰好完全反应,其反应方程式为______,反应后溶液中离子浓度由大到小的顺序为______,常温下HClO的电离平衡常数为K,则常温下NaClO水解反应的平衡常数为______(用含Ka和Kw的表达式表示)
【答案】Br2 + CO32-+4OH- = 5Br-+ BrO3-+ CO2↑ + 2H2O 6.02×1023 cde 溶液褪色 新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡 g h e f c b Cl2 + 2NaOH =NaClO + NaCl +H2O c(Na+) >c(Cl-) > c(ClO-) > c(OH-) > c(H+) ![]()
【解析】
⑴根据用饱和Na2CO3碱性溶液吸收Br2,生成溴化钠和溴酸钠,同时有CO2放出写出离子方程式,再根据氧化有还原反应电子转移得出答案。
⑵根据萃取、分液,蒸馏步骤所用的仪器得出。
⑶①氯气和水反应生成HClO具有漂白性;②新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡,因此除去氯化氢和水。
③氯气和氢氧化钠反应产生氯化钠、次氯酸钠和水,写出反应方程式,氯化钠和次氯酸的物质的量相等,次氯酸钠水解生成次氯酸和氢氧根离子,溶液呈碱性,再比较离子浓度大小,常温下NaClO水解反应的平衡常数与HClO电离平衡常数和离子积关系。
⑴由图可知,操作Ⅱ中,用饱和Na2CO3碱性溶液吸收Br2,生成溴化钠和溴酸钠,同时有CO2放出,离子方程式为:3Br2 + CO32-+4OH- = 5Br-+ BrO3-+ CO2↑+ 2H2O,由离子方程式可知3个Br2转移5个电子,当0.6 mol Br2被吸收时,转移电子为1mol,即数目为6.02×1023个,故答案为:3Br2 + CO32-+4OH- = 5Br-+ BrO3-+ CO2↑+ 2H2O;6.02×1023。
⑵萃取、分液必须用到的仪器是分液漏斗,烧杯,蒸馏中用到蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶等,所以步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有普通漏斗、玻璃棒、蒸发皿;故选:cde。
⑶①氯气和水反应生成HClO具有漂白性,将氯水滴入品红溶液,溶液褪色,故答案为:溶液褪色。
②新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡;若要制备纯净干燥的Cl2,必须除去氯化氢和水,先通过饱和氯化钠溶液除去氯化氢,再通过浓硫酸除去水,最后通过长进短出收集气体,所以若要制备纯净干燥的Cl2,按气流方向连接各仪器接口,顺序为aghefcb,故答案为:新制取的氯气中含HCl气体,也能与碳酸钠溶液反应产生气泡;ghefcb。
③氯气和氢氧化钠反应产生氯化钠、次氯酸钠和水,方程式为:Cl2 + 2NaOH =NaClO + NaCl +H2O;恰好完全反应时氯化钠和次氯酸的物质的量相等,次氯酸钠水解生成次氯酸和氢氧根离子,溶液呈碱性,离子浓度大小顺序为:c(Na+) >c(Cl-) > c(ClO-) > c(OH-) > c(H+),常温下NaClO水解反应的平衡常数![]() ;故答案为:Cl2 + 2NaOH =NaClO + NaCl +H2O;c(Na+) >c(Cl-) > c(ClO-) > c(OH-) > c(H+);
;故答案为:Cl2 + 2NaOH =NaClO + NaCl +H2O;c(Na+) >c(Cl-) > c(ClO-) > c(OH-) > c(H+);![]() 。
。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是___(填编号)。若测定结果偏高其原因可能是__(填字母)。
A.配制标准溶液的固体NaOH中混有Na2O杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是___。
(3)如图是某次滴定时滴定管中的液面,其读数为___mL。

(4)根据下列数据,请计算待测盐酸的浓度:___molL-1。
滴定次数 | 待测体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |