题目内容
【题目】回答下列问题:
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图。
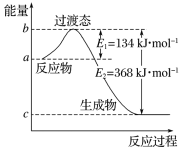
请写出NO2和CO反应的热化学方程式:___。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知:③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=___。
O2(g)=CO2(g)+2H2O(l) ΔH=___。
(3)CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写离子符号);若所得溶液c(HCO3)∶c(CO32)=2∶1,溶液pH=___。(室温下,H2CO3的K1=4×107;K2=5×1011)
【答案】NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1 CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.4 kJ·mol-1 CO32 10
O2(g)=CO2(g)+2H2O(l) ΔH=-764.4 kJ·mol-1 CO32 10
【解析】
(1)根据反应物和生成物总能量进行判断;
(2)根据盖斯定律进行求算;
(3)根据第二步电离平衡常数K2=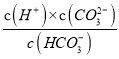 计算。
计算。
(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量(368kJ-134kJ)=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1;
(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
根据盖斯定律,由②![]() ①
①![]() +③
+③![]() 得反应CH3OH(g)+
得反应CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-192.9kJ·mol-1![]() 49.0kJ·mol-1
49.0kJ·mol-1 ![]() +(-44kJ·mol-1)
+(-44kJ·mol-1)![]() =-764.4 kJ·mol-1;
=-764.4 kJ·mol-1;
(3)CO2可以被NaOH溶液捕获。若所得溶液pH=13,因为得到溶液的碱性较强,所以CO2主要转化为CO32;若所得溶液c(HCO3)∶c(CO32)=2∶1,则根据第二步电离平衡常数K2=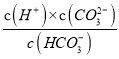 =
=![]() =5×10-11,所以c(H+)=1×10-10mol/L,溶液pH=10。
=5×10-11,所以c(H+)=1×10-10mol/L,溶液pH=10。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】溴是一种重的化工原料,从淡化海水中提取溴的工艺流程如下:
![]()
⑴操作Ⅱ中,用饱和Na2CO3碱性溶液吸收Br2,过程中有CO2产生,反应的粒子方程式为______,当0.6 mol Br2被吸收时,转移电子的数目为______
![]() 步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有______
步骤Ⅳ包含萃取,分液和蒸馏,该过程中不必用到的仪器有______![]() 填序号
填序号![]()
a.烧杯 b.分液漏斗c.普通漏斗 d.玻璃棒 e.蒸发皿 f.冷凝管
![]() 某化学兴趣小组利用高锰酸钾和浓盐酸反应制取氯气,并探究氯水的性质
某化学兴趣小组利用高锰酸钾和浓盐酸反应制取氯气,并探究氯水的性质
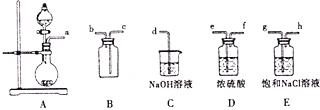
①将A,B,C相连,制得Cl2后加入适量水,即可制得氯水,将所得氯水分为两份,进行甲,乙两个实验,实验操作如下,将现象填入下表:
实验序号 | 实验操作 | 现象 |
甲 | 将氯水滴入品红溶液 | ______ |
乙 | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 |
②由实验乙不能推出氯气与水反应的产物具有酸性,原因是______,若要制备纯净干燥的Cl2,按气流方向连接各仪器接口,顺序为a→_____→_____→_____→_____→_____→_____→d
![]() 实验完毕后,假设装置C中氢氧化钠和
实验完毕后,假设装置C中氢氧化钠和![]() 恰好完全反应,其反应方程式为______,反应后溶液中离子浓度由大到小的顺序为______,常温下HClO的电离平衡常数为K,则常温下NaClO水解反应的平衡常数为______(用含Ka和Kw的表达式表示)
恰好完全反应,其反应方程式为______,反应后溶液中离子浓度由大到小的顺序为______,常温下HClO的电离平衡常数为K,则常温下NaClO水解反应的平衡常数为______(用含Ka和Kw的表达式表示)
【题目】重铬酸钾别名为红矾钾,室温下为橙红色晶体,溶于水,不溶于乙醇。它被国际癌症研究机构划归为第一类致癌物质,而且是强氧化剂,在实验室和工业中都有很广泛的应用。实验小组研究酸性条件下K2Cr2O7溶液和H2O2溶液的反应。相关资料如下:
序号 | 资料 |
① | Cr2(SO4)3溶液呈绿色 |
② | 酸性条件下,K2Cr2O7溶液和H2O2溶液反应生成CrO5,CrO5进一步反应生成Cr3+和O2 |
③ | CrO5可溶于水,易溶于乙醚得到蓝色溶液 |
④ | 乙醚是一种无色不溶于水,密度比水小的有机溶剂,化学性质稳定 |
甲同学采用如图装置进行实验,探究了酸性条件下K2Cr2O7溶液和H2O2溶液的反应产物,实验步骤、操作等内容如下:
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装仪器 | —— |
Ⅱ | ? | —— |
Ⅲ | 向盛有H2O2溶液的仪器X中加入一定量的K2Cr2O7溶液和硫酸 | 溶液立即变为紫红色,此时pH=1,观察到溶液中持续产生气泡,最终溶液变为绿色 |

回答下列问题:
(1)用以上装置证明实验中产生的气体有氧气,装置的连接顺序是a→__→__→__→__。
(2)图中仪器X的名称是___。
(3)实验步骤Ⅱ是___。
(4)实验中紫红色溶液含有CrO5。
①验证紫红色溶液中含有CrO5的操作及现象是___。
②已知CrO5的结构式为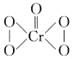 ,生成CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
,生成CrO5的反应,不是氧化还原反应,则该反应的离子方程式为___。
(5)对上述实验中产生氧气、溶液变为绿色的原因,做出的假设①是CrO5在酸性溶液中不稳定,自身氧化还原生成Cr3+和O2。你还能做出的假设②是___。
(6)设计实验,选择合适的试剂,验证(5)中的假设①,你的设计是___。
【题目】按要求回答下列问题:
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是___。
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中![]() 不变 D.溶液中
不变 D.溶液中![]() 减小
减小
(2)常温下将0.15mol/L稀硫酸V1mL与0.1mol/L NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=___(溶液体积变化忽略不计)。
(3)常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,则该溶液的pH可能是___。
(4)常温下,在pH=9的CH3COONa溶液中,由水电离出的OH-浓度___。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__;
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) __。