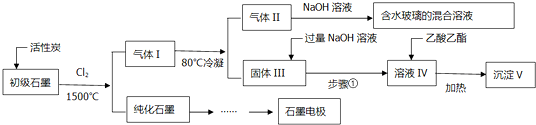
题目内容
7.2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标.研究表明,PM2.5约60%来源于某些气体污染物在空气中转变而成的二次颗粒物.这些气体污染物主要有二氧化硫、氮氧化物、氨气、挥发性有机物.因此,控制、治理PM2.5污染源成为环保的重要课题.(1)研究表明,TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,如图1所示,OH与NO2的反应为
NO2+OH→HNO3.写出OH与NO反应的化学方程式:3OH+NO=HNO3+H2O,该反应中被氧化的元素是N.
(2)如图2所示的电解装置能吸收和转化NO2、NO和SO2.阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生.请将S2O42-吸收NO2的离子方程式配平,并标明电子转移的方向和数目.
4S2O42-+2NO2+8OH-→8SO32-+1N2+4H2O
(3)已知上述电解装置阳极反应为:SO2-2e+2H2O→SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84L的气体,阳极区新生成质量分数为49%的硫酸100g,则被吸收气体中NO2和NO的物质的量之3:4.
(4)PM2.5产生的主要来源,是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质.一般而言,粒径2.5微米至10微米的粗颗粒物主要来自扬尘等;2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物的排放等.请你结合信息,给出降低PM2.5排放的对策(至少两条):采用新能源、减少机动车有害尾气的排放.
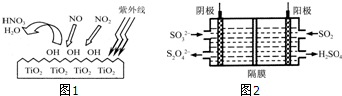
分析 (1)根据方程式NO2+OH→HNO3可知,活性基团OH具有强氧化性,所以OH具有能把NO氧化生成硝酸,根据原子守恒可知,反应中还应该有水生成,结合化合价的变化分析;
(2)S2O42-中S元素的化合价从+3价升高到+4价,失去1个电子.NO2中氮元素的化合价从+4价降低到0价,得到4个电子,所以根据电子得失守恒可知,氧化剂NO2与还原剂S2O42-中S2O42-的物质的量之比是1:2,根据原子守恒可知,反应中还应该有水生成;
(3)根据气体的物质的量以及电解时转移的电子守恒列方程组计算;
(4)由于2.5微米以下的细颗粒物(PM2.5)主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物的排放等.
解答 解:(1)根据方程式NO2+OH→HNO3可知,活性基团OH具有强氧化性,所以OH具有能把NO氧化生成硝酸,根据原子守恒可知,反应中还应该有水生成,因此反应的化学方程式是NO+3OH→HNO3+H2O,在反应中NO中+2价的氮元素化合价升高到+5价,所以被氧化的元素是N;
故答案为:NO+3OH→HNO3+H2O;N;
(2)根据方程式可知,S2O42-中S元素的化合价从+3价升高到+4价,失去1个电子.NO2中氮元素的化合价从+4价降低到0价,得到4个电子,所以根据电子得失守恒可知,氧化剂NO2与还原剂S2O42-中S2O42-的物质的量之比是1:2,根据原子守恒可知,反应中还应该有水生成,所以配平后的方程式应该是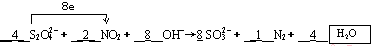 ;
;
故答案为: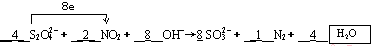 .
.
(3)标准状况下7.84 L的气体的物质的量是7.84L÷22.4L/mol=0.35mol,
设NO2和NO的物质的量分别是x和y,
则x+y=0.35mol.100 g 49%的硫酸中硫酸的质量是49g,物质的量是49g÷98g/mol=0.5mol,
则根据方程式SO2-2e-+2H2O→SO42-+4H+可知,转移电子的物质的量是0.1mol,
所以根据电子得失守恒可知,4x+2y=1mol,解得x=0.15mol、y=0.20mol,所以被吸收气体中NO2和NO的物质的量之比为3:4;
故答案为:3:4.
(4)由于2.5微米以下的细颗粒物(PM2.5)主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物的排放等,所以要降低PM2.5排放的对策应该是采用新能源、减少机动车有害尾气的排放;
故答案为:采用新能源、减少机动车有害尾气的排放.
点评 本题考查氧化还原反应方程式的配平、计算以及有关判断,大气污染以及治理,电解原理的有关应用等,题目涉及的知识点较多,侧重于考查学生的分析能力和对基础知识的综合应用能力,题目难度中等.

 天天练口算系列答案
天天练口算系列答案| A. | 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 | |
| B. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| C. | 石墨转化为金刚石的反应是吸热反应,说明等量的石墨比金刚石能量高 | |
| D. | 某溶液用盐酸酸化无明显现象,再滴加氯化钡溶液有白色沉淀产生,说明溶液中有SO42- |
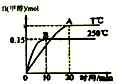
| A. | 混合气体的密度不变能说明该反应到达平衡状态 | |
| B. | a>0 | |
| C. | 其他条件不变,若减小容积体积,CO质量分数增大 | |
| D. | 平衡常数K:T℃时大于250℃ |
| A. | I元素的质量数是131 | B. | I元素的中子数是78 | ||
| C. | I原子5p亚层有一个未成对电子 | D. | I原子有53个能量不同的电子 |
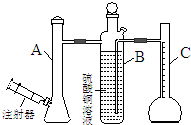
| A. | 反应前后抽气使B中导管内外液面持平 | |
| B. | 用饱和食盐水代替A装置中的蒸馏水 | |
| C. | 把A装置浸入盛有冰水混合物的水槽中 | |
| D. | 在B装置中的硫酸铜溶液表面覆盖一层苯 |
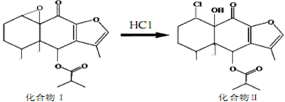 我国科研人员以蹄叶橐吾为原料先制得化合物Ⅰ,再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )
我国科研人员以蹄叶橐吾为原料先制得化合物Ⅰ,再转化为具有抗癌抑菌活性的倍半萜化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( )| A. | 化合物Ⅰ能使酸性高锰酸钾溶液褪色 | |
| B. | 化合物Ⅰ分子中含有5个手性碳原4 | |
| C. | 化合物Ⅱ一定条件下能发生取代、消去及加成反应 | |
| D. | 检验化合物Ⅱ是否含化合I可用Br2的CCl4溶液 |
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 氨水吸收足量的SO2气体:NH3•H2O+SO2═NH4++HSO3- | |
| C. | 少量SO2通入NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ | |
| D. | 向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| A. | 等质量的铝与足量的烧碱和盐酸反应生成氢气的质量相同 | |
| B. | 等质量的铜与足量的浓硫酸和浓硝酸反应生成气体的物质的量相同 | |
| C. | 相同物质的量的烧碱和纯碱与足量盐酸反应,消耗盐酸的体积相同 | |
| D. | 相同质量的硫与足量烧碱、浓硫酸、浓硝酸反应,转移电子数相同 |