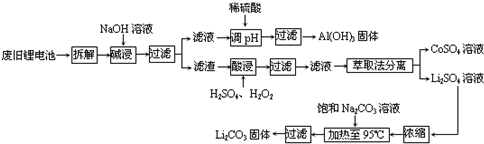
题目内容
7.石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下: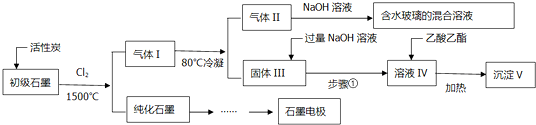
(1)高温反应后,石墨中氧化物杂质均转化为相应的氯化物,气体Ⅰ中的碳氧化合物主要为CO,气体Ⅱ为SiCl4,由其得到水玻璃的化学方程式为SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O
(2)步骤①为搅拌,过滤,则得到的溶液Ⅳ中的阴离子有AlO2-、Cl-、OH-;
(3)100kg初级石墨最多可获得的沉淀Ⅴ的质量为:7.8kg.
分析 高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中碳氧化物主要为CO,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,固体Ⅲ存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,过滤得到的溶液中含有偏铝酸钠、过量的氢氧化钠;
(1)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中碳氧化物主要为CO,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠;
(2)金属氯化物的沸点均高于150℃,则固体Ⅲ中存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,过滤得到的溶液中含有偏铝酸钠、过量的氢氧化钠;
(3)偏铝酸钠发生水解,加入乙酸乙酯除去过量的氢氧化钠,且加热条件下水解平衡一直正向移动,得到氢氧化铝沉淀、醋酸钠、乙醇;
根据氧化铝的含量计算氧化铝质量,再根据Al元素守恒计算氢氧化铝的质量.
解答 解:(1)石墨过量高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中碳氧化物主要为CO,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,化学反应方程式为:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O,
故答案为:CO;SiCl4;SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
(2)金属氯化物的沸点均高于150℃,则固体Ⅲ中存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,搅拌、过滤得到溶液IV,故溶液IV中的阴离子有:AlO2-、OH-、Cl-,
故答案为:AlO2-、OH-、Cl-;
(4)偏铝酸钠发生水解,加入乙酸乙酯除去过量的氢氧化钠,且加热条件下水解平衡一直正向移动,得到氢氧化铝沉淀、醋酸钠、乙醇,由溶液IV生成沉淀V的总反应的离子方程式为:AlO2-+CH3COOCH2CH3+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CH3COO-+CH3CH2OH+Al(OH)3↓,
Al2O3的质量分数为5.1%,则100kg初级石墨中氧化铝的质量=100kg×5.1%=5.1kg,
根据Al元素守恒,可知氢氧化铝的质量=$\frac{\frac{5.1kg×54}{102}}{\frac{27}{78}}$=7.8kg;
故答案为:7.88kg.
点评 本题考查物质制备分离、阅读题目获取信息能力、化学方程式及离子方程式书写、化学计算等,需要学生具备扎实的基础及迁移运用能力,难度中等.

| A. | 在Fe2(SO4)3溶液中加入过量的铁粉,过滤,在滤液中加入过量的NaOH溶液 | |
| B. | 用铁粉与稀硫酸充分反应,然后再加入过量的氨水 | |
| C. | 在FeCl2溶液上加一层苯,然后将滴管插入到FeCl2溶液液面以下,慢慢滴加NaOH溶液(溶液中不能有气泡,配制FeCl2和NaOH溶液的蒸馏水必须加热煮沸) | |
| D. | 在生成Fe(OH)3的悬浊液中加过量的铁粉 |

| 实验一 | 实验二 | |
| 实验药品 | 4g P2O5、8mL无水乙醇 | |
| 实验条件 | 酒精灯加热 | 水浴加热 |
实验现象 | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇,立即产生白雾,当用酒精灯加热后,有气泡产生,并逐渐沸腾,生成粘稠状液体,集气瓶C中有无色液体产生. | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇立即产生白雾,当用水浴加热后,无气泡产生,生成粘稠状液体,集气瓶C中有无色液体产生. |
(1)写出装置中仪器A的名称分液漏斗;
(2)装置中B、C之间长导管的作用是导气、冷凝,浓硫酸的作用是干燥气体;
(3)实验二中,完成水浴加热必需的玻璃仪器有大烧杯、酒精灯;
(4)实验一、二中当加入无水乙醇时,均有白雾产生,请简述产生白雾的原因:P2O5溶解于乙醇,迅速放出大量的热,局部温度较高,使得少量乙醇气化,形成白雾;
(5)经检验集气瓶C中无色液体为磷酸三乙酯,请在图中虚线框内画出实验装置(含试剂)用于验证生成的乙烯;
(6)根据实验现象判断以P2O5作为催化剂获得乙烯的反应条件是加热至较高温度.
 钠和铜的单质及其化合物在生活实际中有着广泛的应用.
钠和铜的单质及其化合物在生活实际中有着广泛的应用.(1)Cu2+基态的核外电子排布式为1s22s22p63s23p63d9;
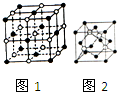
(2)NaCl晶体的晶胞结构如图1所示,在NaCl的晶胞中含有的阴离子的个数为4,阳离子的配位数为6;
(3)钠的有关卤化物的熔点间下表,钠的卤化物熔点按NaF、NaCL、NaBr、NaI顺序降低的原因是氟离子、氯离子、溴离子、碘离子的半径变小,所以NaF、NaCL、NaBr、NaI晶体的晶格能变小,所以熔点降低;
| NaF | NaCl | NaBr | NaI | |
| 熔点/℃ | 993 | 801 | 747 | 661 |
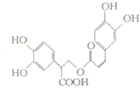 迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )| A. | 7:6:1 | B. | 7:6:5 | C. | 6:7:1 | D. | 6:7:5 |
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | “酸可除锈”、“洗涤剂可去油”都是发生了化学变化 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 油脂有油和脂肪之分,在酸性条件下水解生成高级脂肪酸和甘油 |
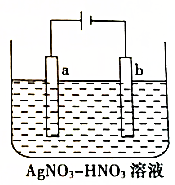 如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.
如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.