题目内容
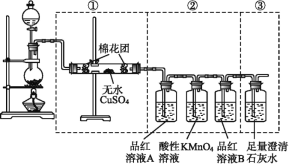
【题目】氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中AlN的质量分数。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
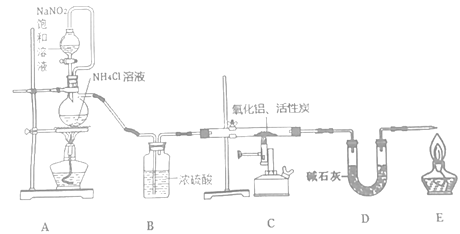
回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃___(“A”、“C”或“E”)处的酒精灯或酒精喷灯。
(2)装置A中发生反应的离子方程式为___,装置C中主要反应的化学方程式为___,制得的AlN中可能含有氧化铝、活性炭外还可能含有___。
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是___(写出一种措施即可)。
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为___。
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是___。
【答案】A NH4++ NO2-![]() N2↑+2H2O Al2O3 +N2+3C
N2↑+2H2O Al2O3 +N2+3C ![]() 2AlN +3CO Al4C3 减缓亚硝酸钠的滴加速度或降低A处酒精灯加热的温度 61.5% NH4Cl受热分解生成氨气和氯化氢,氯化氢破坏了Al表面的氧化膜,便于Al快速反应
2AlN +3CO Al4C3 减缓亚硝酸钠的滴加速度或降低A处酒精灯加热的温度 61.5% NH4Cl受热分解生成氨气和氯化氢,氯化氢破坏了Al表面的氧化膜,便于Al快速反应
【解析】
⑴A装置制取氮气,浓硫酸干燥,氮气排除装置内的空气,反之Al反应时被空气氧化。
⑵根据氧化还原反应写出A、C的反应式,利用物质之间的反应推出C中可能出现的产物。
⑶从影响反应速率的因素思考减缓氮气生成速率。
⑷根据关系得出AlN的物质的量,计算产物中的质量分数。
⑸氯化铵在反应中易分解,生成的HCl在反应中破坏了Al表面的氧化膜,加速反应。
⑴A处是制取氮气的反应,可以排除装置内的空气,反之反应时Al被氧气氧化,因此最先点燃A处的酒精灯或酒精喷灯,故答案为:A。
⑵装置A是制取氮气的反应,A中发生反应的离子方程式为NH4++ NO2- ![]() N2↑+2H2O,装置C中主要反应的化学方程式为Al2O3 +N2+3C
N2↑+2H2O,装置C中主要反应的化学方程式为Al2O3 +N2+3C ![]() 2AlN +3CO,制得的AlN中可能含有氧化铝、活性炭外还可能是Al和C形成的化合物Al4C3,故答案为:NH4++ NO2-
2AlN +3CO,制得的AlN中可能含有氧化铝、活性炭外还可能是Al和C形成的化合物Al4C3,故答案为:NH4++ NO2- ![]() N2↑+2H2O;Al2O3 +N2+3C
N2↑+2H2O;Al2O3 +N2+3C ![]() 2AlN +3CO;Al4C3。
2AlN +3CO;Al4C3。
⑶实验中发现氮气的产生速率过快,严重影响尾气的处理,减缓氮气的生成速度采取的措施是减缓亚硝酸钠的滴加速度或降低A处酒精灯加热的温度,故答案为:减缓亚硝酸钠的滴加速度或降低A处酒精灯加热的温度。
⑷生成氨气的体积为1.68 L即物质的量为0.075mol,根据方程式关系得出AlN的物质的量为0.075mol,则所得产物中AlN的质量分数为![]() ,故答案为:61.5%。
,故答案为:61.5%。
⑸在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,可能是NH4Cl受热分解生成氨气和氯化氢,氯化氢破坏了Al表面的氧化膜,从而Al直接和氮气反应,因此其主要原因是NH4Cl受热分解生成氨气和氯化氢,氯化氢破坏了Al表面的氧化膜,故答案为:NH4Cl受热分解生成氨气和氯化氢,氯化氢破坏了Al表面的氧化膜,便于Al快速反应。