��Ŀ����
����Ŀ����Ԫ����������ȶ���һ��ͬ���������ǻ�ɫ�����������ͣ�1912��E.Beckmann�����ڵ��еı��㽵�ͷ����������S8���ӡ�1891�꣬M.R.Engel��Ũ�������������εı�����Һ��0���������״��Ƶ���һ�����ε�![]() ������֤������S6���ӡ�����˵����ȷ����
������֤������S6���ӡ�����˵����ȷ����
A.S6��S8���Ӷ�����Sԭ����ɣ�����������һ������
B.S6��S8���ӷֱ������۷�Ӧ�����ò��ﲻͬ
C.S6��S8���ӷֱ��������������Ӧ���Եõ�SO3
D.��������S6��S8���ӷֱ���������KOH��Ӧ������KOH�����ʵ�����ͬ
���𰸡�D
��������
Aѡ����S6��S8���Ӷ�����Sԭ����ɣ������Dz�ͬ�����ʣ���Ϊͬ�������壬��A����
Bѡ�S6��S8����Ԫ�صIJ�ͬ���ʣ���ѧ�������ƣ�������Ƿֱ������۷�Ӧ�����ò�����ͬ����B����
Cѡ�����������������������S6��S8���ӷֱ���������Ӧ���Եõ�SO2����C����
Dѡ���������S6��S8���ӣ�����ԭ�ӵ����ʵ�����ͬ��������Ƿֱ���������KOH��Ӧ������KOH�����ʵ�����ͬ����D��ȷ��
������������ΪD��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����1���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У�������Ӧ2NO2(g)![]() N2O4(g)��H��0����Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��
N2O4(g)��H��0����Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ��ʾ��
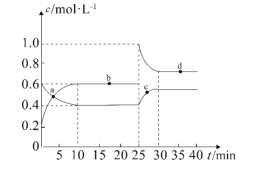
��0��10min��ƽ����Ӧ���ʣ�v((NO2)=___________mol��L��1��min��1��
��a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����v(��)��v(��)�ĵ���___________��
��������Ӧ��Ӧ���е�25minʱ�������������ڳ���һ����NO2�����´ﵽƽ����������NO2�����������___________(������������������������С��)���÷�Ӧ��ƽ�ⳣ��K=___________(����������1λС��)��
��2��һ���¶��º��������У���Ӧ2N2O(g)![]() 2N2(g)+O2(g)���ڵ���������ʱ�ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
2N2(g)+O2(g)���ڵ���������ʱ�ܴ�������N2O�ķֽ����ʣ���Ӧ����Ϊ��
��һ��I2(g)![]() 2I(g)(�췴Ӧ)
2I(g)(�췴Ӧ)
�ڶ���I(g)+N2O(g)��N2(g)+IO(g)(����Ӧ)
������IO(g)+N2O(g)��N2(g)+O2(g)+I(g)(�췴Ӧ)
ʵ�����������ʱN2O�ֽ����ʷ���v=k��c(N2O)��[c(I2)]0.5��kΪ���ʳ����������б�����ȷ����___________(����)��
a��N2O�ֽⷴӦ�У�k(����)>k(�⣩b����һ�����ܷ�Ӧ�������������
c���ڶ�����ܱȵ�������d��I2Ũ����N2O�ֽ�������
��3��F.Daniels�������ò�ѹ���ڸ��Է�Ӧ�����о���25��ʱN2O5(g)�ֽⷴӦ��
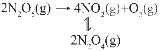
����NO2����ΪN2O4�ķ�Ӧ����Ѹ�ٴﵽƽ�⣬��ϵ����ѹǿp��ʱ��t�ı仯���±���ʾ��t=��ʱ��N2O5(g)��ȫ�ֽ⣩��
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | �� |
p/kPa | 36.0 | 40.5 | 42.6 | 45.9 | 49.2 | 61.2 | 62.3 | 64.0 |
��25��ʱ2NO2(g)![]() N2O4(g)��Ӧ��ƽ�ⳣ��Kp=___________kPa��1��
N2O4(g)��Ӧ��ƽ�ⳣ��Kp=___________kPa��1��
��t=200minʱ�������ϵ��p(N2O4)=6.5kPa�����ʱ��N2O5ת����Ϊ___________��(����������1λС��)