题目内容
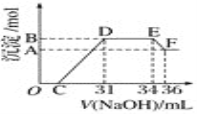
【题目】在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法正确的是( )
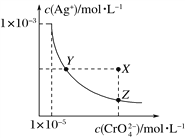
A. t ℃时,Ag2CrO4的Ksp为1×10-8;
B. t ℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,CrO42-先沉淀;
C. t ℃时,Y点和Z点时Ag2CrO4的Ksp相等;
D. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为Z点;
【答案】C
【解析】分析:A.t℃时,Ag2CrO4的Ksp=c2(Ag+)·c(CrO42-);
B.结合Ksp及c(Ag+)计算阴离子浓度,阴离子浓度小的先沉淀;
C.根据Ksp只与温度有关判断;
B.饱和Ag2CrO4溶液中加入K2CrO4,c(CrO42-)增大,平衡逆向移动,c(Ag+)减小。
详解:A.t℃时,Ag2CrO4的Ksp=c2(Ag+)·c(CrO42-)=(1×10-3)2×(1×10-5)=1×10-11,A错误;
B.c(Cl-)=1.8×1010/0.01 mol/L=1.8×10-8 mol/L,c(CrO42-)=1×1011/(0.01)2 mol/L=1×10-7 mol/L,Cl-先沉淀,B错误;
C.Ksp只与温度有关,则t℃时,Y点和Z点时Ag2CrO4的Ksp相等,C正确;
D.饱和Ag2CrO4溶液中加入K2CrO4,c(CrO42-)增大,平衡逆向移动,c(Ag+)减小,则饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为Z点,D错误;答案选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目