题目内容
【题目】研究氮的循环和转化对生产、生活有重要的价值。
I.(1)写出实验室制备氨气的化学方程式________ 。
II.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。
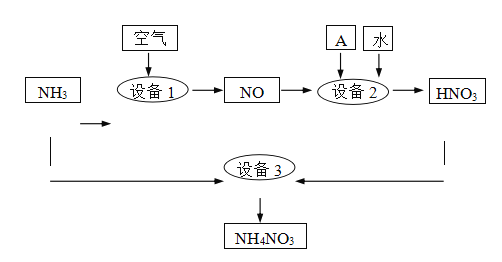
(2)设备1、3中发生反应的化学方程式分别是______、 ________ 。设备2中通入的物质A是________。
III.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH4+和NH3H2O的形式存在。某工厂处理氨氮废水的流程如下:
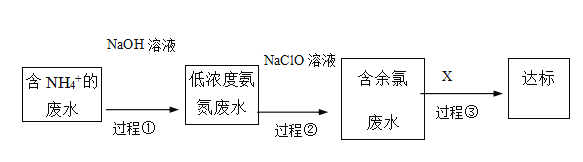
(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,写出NH4+转化为NH3的离子方程式________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为___、_______。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)_________。
a.KOH b.Na2SO3 c.KMnO4 D.NaCl
写出其中一个反应的离子方程式__________ 。
【答案】2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O 4NH3+5O2 ==== 4NO+6H2O HNO3+ NH3=NH4NO3 O2或者空气 NH4++OH-= NH3↑+H2O N2 NaCl b SO32-+ClO-= SO42-+Cl-或者SO32-+HClO= SO42-+Cl-+H+
【解析】
I.(1)实验室用NH4Cl和Ca(OH)2制备氨气,其反应的化学方程式为:2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O。答案:2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O。
II.(2)设备1中是NH3和O2发生反应,化学方程式为4NH3+5O2 ==== 4NO+6H2O;设备II中是HNO3和NH3发生反应,发生反应的化学方程式是HNO3+ NH3=NH4NO3 。设备2中发生的反应为:4NO+O2+H2O=4 HNO3,所以通入的物质A是O2或者空气。答案:4NH3+5O2 ==== 4NO+6H2O;HNO3+ NH3=NH4NO3;O2或者空气。
III.(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,使NH4+转化为NH3,反应的离子方程式为:NH4++OH-= NH3↑+H2O 。答案:NH4++OH-= NH3↑+H2O。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应的方程式为:3NaClO+ 2NH3=3NaCl+N2![]() +3H2O,所以含氮元素、氯元素的物质化学式为N2 、NaCl 。 答案:N2 ;NaCl。
+3H2O,所以含氮元素、氯元素的物质化学式为N2 、NaCl 。 答案:N2 ;NaCl。
(5)含余氯废水的主要成分是NaClO和HClO,要除去需加入还原性物质Na2SO3 ,反应的离子方程式为:SO32-+ClO-= SO42-+Cl-和SO32-+HClO= SO42-+Cl-+H+。答案:b;SO32-+ClO-= SO42-+Cl-或SO32-+HClO= SO42-+Cl-+H+。