题目内容
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为
| A.300 mL | B.400 mL | C.450 mL | D.500 mL |
B
解析

下列过程一定涉及氧化还原反应的是( )
| A.萃取 | B.电解 | C.净水 | D.分馏 |
下列反应中转移电子的物质的量不等于2 mol的是
| A.1 mol Al与含1mol H2SO4的稀硫酸溶液反应 |
| B.1mol Cu与含4mol HNO3的稀硝酸溶液反应 |
| C.1 mol MnO2与含2 mol H2O2的双氧水反应 |
| D.1 mol Cu与含2 mol H2SO4的浓硫酸共热 |
铬铁矿的主要成分的化学式为FeO·Cr2O3,还含有SiO2、Al2O3等杂质。工业上常采用固体碱熔氧化法用铬铁矿粉制备重铬酸钾,流程为: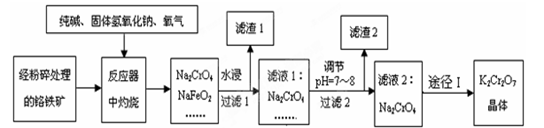
已知:①NaFeO2遇水强烈水解;
②重铬酸钾为橙红色针状晶体,溶于水,不溶于乙醇,有强氧化性;
③2CrO42- + 2H+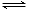 Cr2O72-+ H2O
Cr2O72-+ H2O
(1)灼烧操作一般在坩埚中进行,下列物质适合用来制作此实验坩埚材料的是
| A.铁 | B.氧化铝 | C.石英 | D.陶瓷 |
②写出Cr2O3和纯碱、氧气反应生成Na2CrO4的化学方程式为 ;
③NaFeO2水浸时强烈水解生成氢氧化铁沉淀,离子方程式为___ ___。
(3)滤液1的成分除Na2CrO4、NaOH外,还含有(填化学式) ,
(4)通过途径Ⅰ从Na2CrO4溶液获得K2Cr2O7晶体,操作步骤有:“酸化”→加KCl固体→蒸发浓缩→操作a→过滤→洗涤→干燥。
① “酸化”步骤用醋酸调节溶液pH<5,其目的是 ;
②操作a的名称 。
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是
| A.当a = 0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl- |
| B.当a = 0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C.若溶液中Br-有一半被氧化时, c(Fe3+): c(Br-):c(Cl-) =1:1:3 |
| D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-) |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和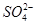 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
| A.9.0 L | B.13.5 L | C.15.7 L | D.16.8 L |
O3具有强氧化性,将O3通入KI溶液中发生反应:O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是 ( )。
| A.配平后的离子方程式为2O3+2I-+4H+=I2+2O2+2H2O |
| B.每生成1 mol I2转移电子2 mol |
| C.O2是还原产物之一 |
| D.该反应能说明O2的氧化性大于I2的 |
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+Cl2―→CO2+N2+Cl-+H2O(未配平)中,如果有6 mol Cl2完全反应,则被氧化的OCN-的物质的量是 ( )。
| A.2 mol | B.3 mol | C.4 mol | D.6 mol |
铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 2PbO+2SO2;③制粗铅:PbO+C
2PbO+2SO2;③制粗铅:PbO+C Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO Pb+CO2。
Pb+CO2。
下列说法正确的是( )
| A.浮选法富集方铅矿的过程属于化学变化 |
| B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO |
| C.整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |
| D.将l mol PbS完全冶炼成Pb理论上至少需要6 g碳 |