题目内容
已知:2Fe + 3Br2 = 2FeBr3,Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。下列叙述不正确的是
| A.当a = 0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl- |
| B.当a = 0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C.若溶液中Br-有一半被氧化时, c(Fe3+): c(Br-):c(Cl-) =1:1:3 |
| D.当0<a<0.15时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-) |
C
解析试题分析:16.8 g铁和0.3 mol Br2反应铁过量,所以产物为0.3molFeBr2。A、a = 0.1时, Cl2不足,所以先与Fe2+反应,发生反应的离子方程式正确;B、a = 0.45时,Cl2恰好与FeBr2反应,发生的反应的离子方程式正确;C、若溶液中Br-有一半(0.3mol)被氧化时,此时0.3mol Fe2+需要氯气0.15mol,0.3molBr-需要氯气0.15mol,共用氯气0.3mol,根据质量守恒定律,所以溶液中c(Fe3+): c(Br-):c(Cl-)=1:1:2,产物;D、0<a<0.15时,Fe2+未被全部氧化,溶液中还存在Fe2+,根据电荷守恒定律,2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+ c(OH-)成立,正确,答案选C。
考点:考查氧化还原反应的先后规律的应用,与量有关的氧化还原反应的计算

已知反应:Na2O2 + SO2 = Na2SO4,则下列判断正确的是
| A.硫元素被还原 |
| B.二氧化硫是还原剂 |
| C.过氧化钠既是氧化剂又是还原剂 |
| D.二氧化硫既不是氧化剂也不是还原剂 |
氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
| A.若管道漏气遇氨就会产生白烟 |
| B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 |
| D.生成1molN2有6mol电子转移 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
| A.9.0 L | B.13.5 L | C.15.7 L | D.16.8 L |
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:
(1)Tl3++2Ag=Tl++2Ag+
(2)Ag++Fe2+=Ag+Fe3+
(3)Fe+2Fe3+=3Fe2+,
下列离子氧化性比较顺序正确的是
| A.Tl3+>Fe3+>Ag+ | B.Fe3+>Ag+>Tl3+ |
| C.Tl+>Ag+>Fe2+ | D.Tl3+>Ag+>Fe2+ |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O。
则生成的盐溶液中NaNO2的物质的量为
| A.0.4 mol | B.0.6 mol |
| C.0.8 mol | D.0.2 mol |
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为
| A.300 mL | B.400 mL | C.450 mL | D.500 mL |
火法炼铜首先要焙烧黄铜矿,其反应为2CuFeS2+O2—→Cu2S+2FeS+SO2下列说法正确的是
| A.SO2既是氧化产物又是还原产物 |
| B.CuFeS2仅作还原剂,硫元素被氧化 |
| C.每生成1 mol Cu2S,有4 mol硫被氧化 |
| D.每转移1.2 mol电子,有0.2 mol硫被还原 |
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是( )。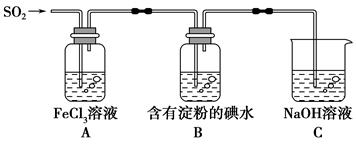
| A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液退色 |
| B.装置C的作用是吸收SO2尾气,防止污染空气 |
| C.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀 |
| D.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色退去 |