题目内容
下列反应中转移电子的物质的量不等于2 mol的是
| A.1 mol Al与含1mol H2SO4的稀硫酸溶液反应 |
| B.1mol Cu与含4mol HNO3的稀硝酸溶液反应 |
| C.1 mol MnO2与含2 mol H2O2的双氧水反应 |
| D.1 mol Cu与含2 mol H2SO4的浓硫酸共热 |
D
解析试题分析:A ,Al与硫酸反应的化学方程式为:2Al+3H2SO4=Al2(SO4)3+3H2↑.可见Al过量。反应按照硫酸来计算。硫酸是1mol,所以发生反应转移电子2mol。正确。B.Cu与稀 HNO3反应的化学方程式为: 3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,可见1mol Cu与消耗8/3mol HNO3.。因此硝酸过量。按照Cu来计算。Cu是+2价的金属,1mol的 Cu转移电子2mol。正确。C.1 mol MnO2与含2 mol H2O2的双氧水反应反应的方程式为2H2O2 2H2O +O2↑.2 mol H2O2发生分解反应作用电子2mol。正确。D.1 mol Cu与含2 mol H2SO4的浓硫酸共热Cu+2H2SO4(浓)
2H2O +O2↑.2 mol H2O2发生分解反应作用电子2mol。正确。D.1 mol Cu与含2 mol H2SO4的浓硫酸共热Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。1mol的Cu发生反应,消耗2mol的硫酸。随着反应的进行,硫酸变稀,这时反应就不再发生。因此转移电子的物质的量小于2mol。
CuSO4+SO2↑+2H2O。1mol的Cu发生反应,消耗2mol的硫酸。随着反应的进行,硫酸变稀,这时反应就不再发生。因此转移电子的物质的量小于2mol。
考点:考查氧化还原反应中的电子转移的的知识。

下列与化学概念有关的说法正确的是( )
| A.化合反应均为氧化还原反应 |
| B.催化剂能改变可逆反应达到平衡的时间 |
| C.金属氧化物均为碱性氧化物 |
| D.石油是混合物,其分馏产品汽油为纯净物 |
下列反应中,既属于氧化还原反应同时又是吸热反应的是
| A.Ba(OH)2.8H2O与NH4Cl反应 | B.铝与稀盐酸 |
| C.灼热的炭与CO2反应 | D.甲烷与O2的燃烧反应 |
汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质产生的大气污染的方法是安装催化转换器,使它们发生反应生成CO2和N2。反应方程式为:2CO+2NO2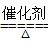 CO2+N2,其中NO2是
CO2+N2,其中NO2是
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
已知粗碘中含有的IBr和ICl受热都会升华,若先在粗碘中加入下列物质中的一种再加热,就可制得纯净的碘。该物质是
| A.KI | B.H2O | C.Zn | D.NaCl |
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:
(1)Tl3++2Ag=Tl++2Ag+
(2)Ag++Fe2+=Ag+Fe3+
(3)Fe+2Fe3+=3Fe2+,
下列离子氧化性比较顺序正确的是
| A.Tl3+>Fe3+>Ag+ | B.Fe3+>Ag+>Tl3+ |
| C.Tl+>Ag+>Fe2+ | D.Tl3+>Ag+>Fe2+ |
2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应后溶液中c(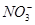 )=0.80 mol·L-1 )=0.80 mol·L-1 |
| B.反应后的溶液最多还能溶解1.82 g Fe |
| C.反应前HNO3溶液的浓度为1.0 mol·L-1 |
| D.1.12 L气体是NO、NO2的混合气体 |
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为
| A.300 mL | B.400 mL | C.450 mL | D.500 mL |
反应①是自海藻灰中提取碘的主要反应,反应②是自智利硝石中提取碘的主要反应:①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2、②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2。已知NaIO3的氧化性与MnO2相近,下列有关说法正确的是 ( )。
| A.I2在反应①中是还原产物,在反应②中是氧化产物 |
| B.两个反应中生成等量的I2时转移的电子数相等 |
| C.NaI和NaIO3在一定条件下能反应生成I2 |
| D.NaIO3在化学反应中只能作氧化剂不能作还原剂 |