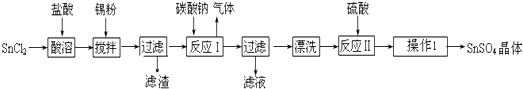
题目内容
11.向10mL2mol/L的氯化铝溶液中加入0.5mol/L的烧碱溶液,反应得到沉淀0.78g,则加入的烧碱溶液的体积为( )| A. | 30mL | B. | 70mL | C. | 90mL | D. | 140mL |
分析 10mL 2mol/L的AlCl3溶液中氯化铝的物质的量=0.01L×2mol/L=0.02mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.02mol×78g/mol=1.56g>0.78g,说明有两种情况:一为Al3+沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:10mL 2mol/L的AlCl3溶液中氯化铝的物质的量=0.01L×2mol/L=0.02mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.02mol×78g/mol=1.56g>0.78g,说明有两种情况:一为Al3+沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
n(Al(OH)3)=$\frac{0.78g}{78g/mol}$=0.01mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.01mol×3=0.03mol,加入NaOH溶液的体积为$\frac{0.03mol}{0.5mol/L}$=0.06L=60mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.02mol 0.06mol 0.02mol
溶解的氢氧化铝为0.02mol-0.01mol=0.01mol
Al(OH)3+OH-═AlO2-+2H2O
0.01mol 0.01mol
则消耗的碱的物质的量为0.06mol+0.01mol=0.07mol,
加入NaOH溶液的体积为$\frac{0.07mol}{0.5mol/L}$=0.14L=140mL,
故选:D.
点评 本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.

| A. | 4 | B. | 16 | C. | 32 | D. | 64 |
| A. | c(H+).c(OH-) | B. | $\frac{c({H}^{+}).c({A}^{-})}{c(HA)}$ | C. | c(H+) | D. | pH |
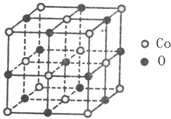 我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.
我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域. .
.