题目内容
10.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | 1.0 mol•L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1的NaOH溶液中:Na+、NH4+、Cl-、HCO3- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:Ca2+、K+、ClO-、NO3- |
分析 A.离子之间发生氧化还原反应;
B.使甲基橙变红色的溶液,显酸性;
C.离子之间结合生成弱电解质、水等;
D.水电离的c(H+)=1×10-13mol•L-1的溶液,为酸或碱溶液.
解答 解:A.H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.使甲基橙变红色的溶液,显酸性,该组离子之间不反应,可大量共存,故B正确;
C.OH-、HCO3-结合生成水和碳酸根离子,OH-、NH4+结合生成弱电解质,不能大量共存,故C错误;
D.水电离的c(H+)=1×10-13mol•L-1的溶液,为酸或碱溶液,酸溶液中不能大量存在ClO-,故D错误;
故选B.
点评 本题考查离子共存问题,为高频考点,本题注意把握相关题给信息及常见离子之间的反应为解答该类题目的关键,学习中注重相关基础知识的积累,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
11.下列实验过程能引起结果偏高的是( )
| A. | 配制100 g 10% CuSO4溶液,称取10 g硫酸铜晶体溶于90 g水中 | |
| B. | 将30%的乙醇溶液和70%的乙醇溶液等体积混和后所得乙醇溶液的质量分数为50% | |
| C. | 配制一定物质的量浓度的稀硫酸溶液时,称量浓硫酸时仰视量筒的刻度线 | |
| D. | 质量分数为10%和90%的两种硫酸等质量混合配制50%的硫酸溶液 |
18.根据下列事实:①X+Y2+=X2++Y;②Z+2H2O(冷水)=Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W做电极组成的原电池,电极反应为W2++2e-=W,Y-2e-=Y2+.可知X、Y、W、Z的还原性由强到弱的顺序是( )
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>X>Y>W | D. | Z>Y>X>W |
5.“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
| A. | 使用氢能源代替化石燃料,减少CO2排放 | |
| B. | 就地在田间焚烧秸秆,减少运输成本 | |
| C. | 改进汽车尾气净化技术,减少污染物的排放 | |
| D. | 研发可降解高分子材料,减少“白色污染” |
15.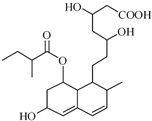 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是
( )
 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列说法不正确的是( )
| A. | 普伐他汀分子中有4种含氧官能团 | |
| B. | 每个普伐他汀分子中含有13个手性碳原子 | |
| C. | 在一定条件下,普伐他汀能发生加成、取代、消去、缩聚反应 | |
| D. | 普伐他汀可以和NaOH溶液、Na2CO3溶液反应,还可以和酸性KMnO4溶液反应 |
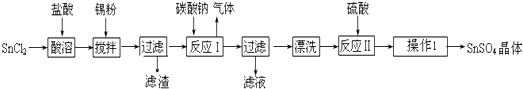
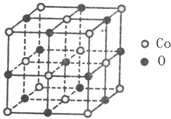 我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.
我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.