题目内容
20.实验室用固体烧碱配制500mL 0.10mol•L-1的NaOH 溶液,需要称取2.0g固体,定容时所需的仪器为胶头滴管.分析 所需的氢氧化钠固体的质量m=CVM;根据定容的操作来分析;
解答 解:用固体烧碱配制500mL 0.10mol•L-1的NaOH 溶液,所需的氢氧化钠固体的质量m=CVM=0.1mol/L×0.5L×40g/mol=2.0g;
定容时,开始直接向容量瓶中注水,至液面离液面1-2cm时改用胶头滴管逐滴加入,至凹液面与刻度线相切即可.故定容时的主要仪器为胶头滴管.
故答案为:2.0;胶头滴管.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和仪器的选用,难度不大,掌握公式的运用和配制原理是解题的关键.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
7.吃水果有助消化,当我们把苹果切开,果肉表面很快便会变成咖啡色,其原因是果肉里的酚在空气中被氧气氧化为有色物质,这些有色物质很快聚合成咖啡色的聚合物,空气中的常见氧化剂是( )
| A. | N2 | B. | O2 | C. | H2O | D. | CO2 |
11.对牙膏的探究要用到许多化学知识.
(1)下表列出了三种牙膏的摩擦剂,请在表中填写三种摩擦剂所属的物质类别.
(2)根据你的推测,牙膏摩擦剂的溶解性是难溶(填“易溶”或“难溶”).
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程图为:[石灰石]$\stackrel{①高温}{→}$[生石灰]$\stackrel{②加水}{→}$[石灰水]$\stackrel{③加Na_{2}CO_{3}溶液}{→}$[碳酸钙]
请写出上述方案中有关反应的化学方程式,并注明反应类型:
①CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO 分解反应;
②CaO+H2O═Ca(OH)2 化合反应;
③Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 复分解反应.
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示,将你的实验方案用流程图表示出来:
石灰石-→
你设计的方案的优点为:反应条件简单,易于操作,所得产品纯度高.
(5)检验牙膏中是否含有碳酸钙的实验方法是:取少量样品,加入稀盐酸,观察有无使澄清石灰水变浑浊的气体产生,若有,则含CaCO3,否则不含.
(1)下表列出了三种牙膏的摩擦剂,请在表中填写三种摩擦剂所属的物质类别.
| 牙膏 | 两面针儿童牙膏 | 珍珠王防臭牙膏 | 中华透明牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
| 摩擦剂的物质类别(指酸、碱、盐、氧化物、两性氢氧化物) |
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程图为:[石灰石]$\stackrel{①高温}{→}$[生石灰]$\stackrel{②加水}{→}$[石灰水]$\stackrel{③加Na_{2}CO_{3}溶液}{→}$[碳酸钙]
请写出上述方案中有关反应的化学方程式,并注明反应类型:
①CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO 分解反应;
②CaO+H2O═Ca(OH)2 化合反应;
③Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 复分解反应.
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示,将你的实验方案用流程图表示出来:
石灰石-→
你设计的方案的优点为:反应条件简单,易于操作,所得产品纯度高.
(5)检验牙膏中是否含有碳酸钙的实验方法是:取少量样品,加入稀盐酸,观察有无使澄清石灰水变浑浊的气体产生,若有,则含CaCO3,否则不含.
8.下列有关叙述正确的是( )
| A. | 常温常压下,11.2LCO2与8.5gNH3所含分子数相等 | |
| B. | 等物质的量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 常温常压下,48gO3和O2的混合气体中含有的氧原子数为3NA | |
| D. | 标准状况下,22.4LH2和Cl2的混合气体中含有的分子数为2NA |
5.下列叙述中,正确的是( )
| A. | 由同种元素组成的物质一定属于纯净物 | |
| B. | NaHCO3在水中电离:NaHCO3═Na++H++CO32- | |
| C. | 含金属元素的离子不一定都是阳离子 | |
| D. | 具有相同质子数的微粒都属于同种元素 |
10.中学化学实验,淡黄色的pH试纸常用于测定溶液的酸碱性.在 25℃,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡H2O?H++OH-△H>0.现欲使平衡向右移动,且所得溶液呈中性,选择的方法是C(字母).
A.向水中加入NaHSO4溶液
B.向水中加入Cu(OH)2固体
C.加热水至100℃[其中c(H+)=1×10-6 mol•L-1]
D.在水中加入H2SO4溶液
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显淡黄色,若用pH计测定,则pH<7 (填“>”“<”或“=”),溶液呈中性(填“酸”“碱”或“中”).
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH=4.
(4)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
(1)已知水中存在如下平衡H2O?H++OH-△H>0.现欲使平衡向右移动,且所得溶液呈中性,选择的方法是C(字母).
A.向水中加入NaHSO4溶液
B.向水中加入Cu(OH)2固体
C.加热水至100℃[其中c(H+)=1×10-6 mol•L-1]
D.在水中加入H2SO4溶液
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显淡黄色,若用pH计测定,则pH<7 (填“>”“<”或“=”),溶液呈中性(填“酸”“碱”或“中”).
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| $\frac{浓度}{(mol•{L}^{_1})}$ | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(4)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
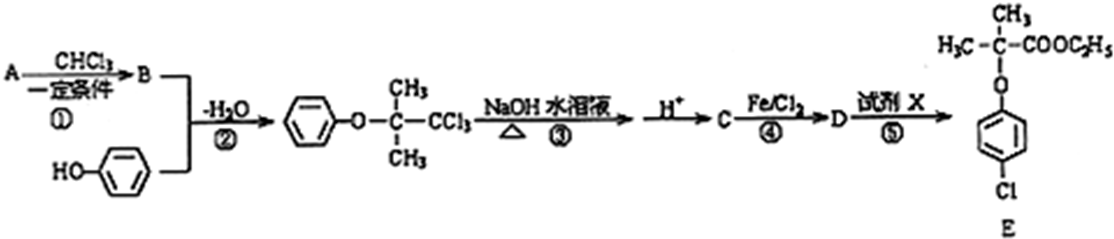
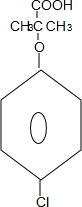 .
.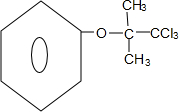 +4NaOH$→_{△}^{H_{2}O}$
+4NaOH$→_{△}^{H_{2}O}$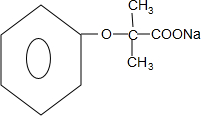 +3NaCl+2H2O.
+3NaCl+2H2O.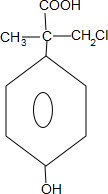 .
.