题目内容
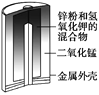
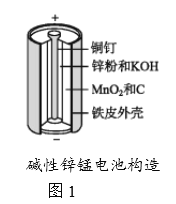
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示。放电时总反应为Zn+2H2O+2MnO2![]() Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
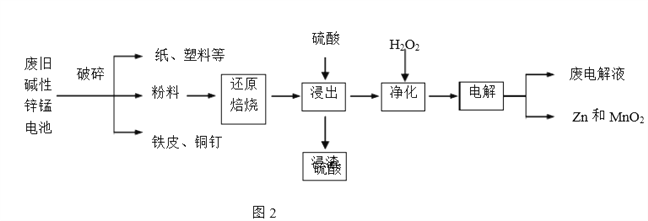
回答下列问题:
(1)碱性锌锰电池中,锌粉、MnO2、KOH的作用分别是(每空只选1个)_______、_______ 、______。
a.正极反应物b. 正极材料 c.负极反应物
d. 负极材料 e. 电子导体 f. 离子导体
(2)“还原焙烧”过程中,无需外加还原剂即可在焙烧过程中将MnOOH、MnO2还原为MnO,起还原作用的物质是___________。
(3)“净化”是在浸出液中先加入H2O2,再加入碱调节溶液pH到4.5左右,再过滤出沉淀。请完整说明这样操作的目的是______________。
Zn(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀的pH | 5.5 | 1.9 | 8.0 |
沉淀完全的pH | 8.0 | 3.2 | 10.0 |
(4) “电解”时,阳极的电极反应式为___。本工艺中应循环利用的物质是____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为_____。
(6)某碱性锌锰电池维持电流0.5 A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有____%的金属锌未参加反应。
【答案】 c a f C /Zn 加入H2O2目的是将Fe2+氧化为Fe3+ 调节pH=4.5是使Fe3+完全沉淀而Mn2+、Zn2+ 仍以离子形式存在于溶液中 Mn2+-2e-+2H2O![]() MnO2+4H+ H2SO4 2MnOOH+6HCl
MnO2+4H+ H2SO4 2MnOOH+6HCl![]() Cl2↑+2MnCl2+4H2O 87
Cl2↑+2MnCl2+4H2O 87
【解析】(1)碱性锌锰干电池中,单质锌为负极反应物,负极材料为铁皮外壳,,石墨棒为正极材料,正极反应为二氧化锰,氢氧化钾相当于电解质溶液,所以答案依次为:c、a、f。
(2)电池中的碳粉和锌粉都是“还原焙烧”过程中的还原剂。
(3)加入过氧化氢的目的是将亚铁离子氧化为铁离子,再加入碱调节溶液的pH至4.5,将铁离子转化为氢氧化铁沉淀除去,这样避免沉淀溶液的锌离子。
(4)电解的溶液为硫酸锰和硫酸锌的混合溶液,因为电解要得到单质锌和二氧化锰,所以电解的阳极反应为Mn2+-2e-+2H2O![]() MnO2+4H+。根据阳极反应,得到溶液中会生成氢离子,因为Mn2+都转化为二氧化锰,锌离子都转化为单质,所以电解至最后应该得到硫酸,硫酸可以循环使用。
MnO2+4H+。根据阳极反应,得到溶液中会生成氢离子,因为Mn2+都转化为二氧化锰,锌离子都转化为单质,所以电解至最后应该得到硫酸,硫酸可以循环使用。
(5)因为“粉料”中的MnOOH与盐酸反应也是得到MnCl2的,所以Mn的化合价降低,只能是Cl化合价升高,因此生成物为氯气,根据化合价升降相等和原子个数守恒得到:2MnOOH+6HCl![]() Cl2↑+2MnCl2+4H2O。
Cl2↑+2MnCl2+4H2O。
(6)每秒通过5×10-6 mol电子,连续工作80分钟,则通过电子为5×10-6 ×80×60=0.024mol。所以参加反应的单质锌为0.012mol,质量为0.78g,所以剩余的锌为6-0.78=5.22g,所以剩余锌为5.22/6=87%。