��Ŀ����
����Ŀ����Դ���ִ���ᷢչ��֧��֮һ��
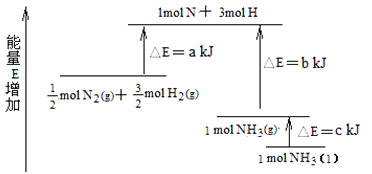
��1����ѧ��Ӧ�е������仯��ͨ����Ҫ����Ϊ�����ı仯��
�����з�Ӧ�У����ڷ��ȷ�Ӧ����___________������ţ���
a. Ba��OH��2��8H2O��NH4Cl��Ͻ���
b. ��������ʯ��ʯ
c. �������ᷴӦ
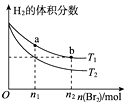
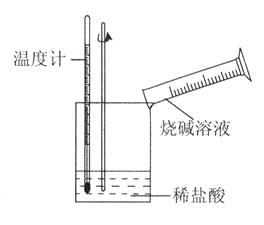
��ijͬѧ��������ͼ��ʾʵ�飬����ϡ�������ռ���Һ�кͷ�Ӧ�������仯��ʵ���������Ӧ�¶����ߣ��ɴ��жϸ÷�Ӧ��_______��������������������������Ӧ�������ӷ���ʽ��_______________��
��2���������ִ����Ӧ����㷺����Դ֮һ��
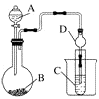
��ͼ��ʾ��ԭ���װ���У��为����_____________________���������ܹ��۲쵽��������____________________________�������ĵ缫��Ӧʽ��_________________________��
ԭ��ع���һ��ʱ���������п6.5g����ų�����__________g��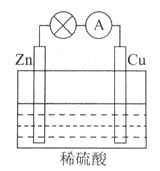
���𰸡���1����c ��1�֣� �����ȣ�1�֣� H++OH����H2O��2�֣�
��2��Zn��1�֣� ͭƬ���������ɫ���ݣ�1�֣� 2H++2e����H2����2�֣� 0.2��2�֣�
��������
(1)�����ݳ����ķ��ȷ�Ӧ��:���е�����ȼ�ա����н������ᷴӦ��������ˮ��Ӧ,�����кͷ�Ӧ;����������Ϸ�Ӧ�����ȷ�Ӧ;���кͷ�Ӧ�Ƿ��ȷ�Ӧ;(2)���ݽ����Ļ����Ժ�ԭ���ԭ������,п������������,ͭ��������Һ�������ӵõ����ӷ�����ԭ��Ӧ��������,�������ĵĽ��������͵缫��Ӧ�е����غ����;
(1)��a��Ba��OH��2��8H2O��NH4Cl��Ͻ������ڳ��������ȷ�Ӧ,��a����;b��̼��Ƹ��·ֽ�������ƺͶ�����̼�ķ�Ӧ�����ȷ�Ӧ,��b����c���������ᷴӦ,�����û���Ӧ,����������ԭ��Ӧ,��Ӧ�����з���,��c��ȷ����ˣ�������ȷ����:c��
���кͷ�Ӧ�Ƿ��ȷ�Ӧ,���ӷ���ʽΪH+ + OH -= H2O ,�����ȷ����:����; H+ + OH - = H2O��
(2)��Ϊп��ͭ����,����п������,���ĵĽ���Ϊп,пʧ��������п���ӽ�����Һ,�缫��ӦʽΪпƬ:Zn -2e-= Zn 2+,ͭƬ�������ӵõ�����������,���Ե缫��ӦʽΪ2H + +2e- = H2��,ԭ��ع���һ��ʱ���,������п6.5g,���ʵ���n(Zn )= 6.5g/65(g.mol-1)=0.1mol,���ݷ�Ӧ: Zn+2H+=H2��+Zn2+ ��ų�������Ϊ0.1mol����ų����������Ϊ0.2g���𰸣�Zn��ͭ�缫�ϲ���������2H ++2e -= H2����0.2��

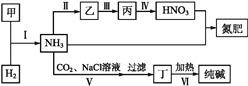
����Ŀ������п�̵�����ճ����������������ĵ��,�乹����ͼ1��ʾ���ŵ�ʱ�ܷ�ӦΪZn+2H2O+2MnO2![]() Zn(OH)2+2MnOOH,�ӷϾɼ���п�̵���л���Zn��MnO2�Ĺ�������ͼ2��ʾ��
Zn(OH)2+2MnOOH,�ӷϾɼ���п�̵���л���Zn��MnO2�Ĺ�������ͼ2��ʾ��
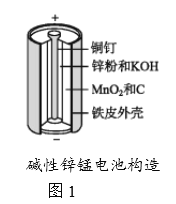
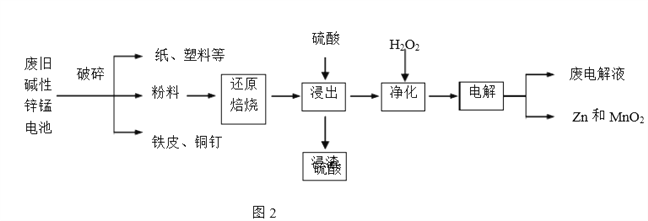
�ش���������:
��1������п�̵���У�п�ۡ�MnO2��KOH�����÷ֱ��ǣ�ÿ��ֻѡ1����_______��_______ ��______��
a��������Ӧ��b�� �������� c��������Ӧ��
d�� �������� e�� ���ӵ��� f�� ���ӵ���
��2������ԭ�����������У�������ӻ�ԭ�������ڱ��չ����н�MnOOH��MnO2��ԭΪMnO����ԭ���õ�������___________��
��3�������������ڽ���Һ���ȼ���H2O2���ټ���������ҺpH��4.5���ң��ٹ��˳�������������˵������������Ŀ����______________��
Zn(OH)2 | Fe(OH)3 | Mn(OH)2 | |
��ʼ������pH | 5.5 | 1.9 | 8.0 |
������ȫ��pH | 8.0 | 3.2 | 10.0 |
��4�� �������ʱ�������ĵ缫��ӦʽΪ___����������Ӧѭ�����õ�������____(�ѧʽ)��
��5��������������ֱ�������Ṳ�ȷ�Ӧ���������Һ����Ҫ�ɷ���ZnCl2��MnCl2�����������е�MnOOH�����ᷴӦ�Ļ�ѧ����ʽΪ_____��
��6��ij����п�̵��ά�ֵ���0.5 A(�൱��ÿ��ͨ��5��10-6 mol����)����������80���Ӽ��ӽ�ʧЧ���������һ�ڵ�������п��Ϊ6 g������ʧЧʱ����____%�Ľ���пδ�μӷ�Ӧ��