题目内容
【题目】由配位键形成的离子[Pt(NH3)6]2+和[PtCl4]2—中,两个中心离子铂的化合价是( )
A.都是+8 B.都是+6 C.都是+4 D.都是+2
【答案】D
【解析】
试题分析:氨气分子不带电荷,所以前者Pt的化合价是+2价;氯离子带1个负电荷,所以后者中Pt的化合价还是+2价,答案选D。

【题目】下列有关氧化还原反应的叙述正确的是
A.氧化还原反应的本质是元素化合价发生变化
B.物质所含元素化合价降低的反应是氧化反应
C.置换反应一定属于氧化还原反应
D.化合反应和分解反应不可能是氧化还原反应
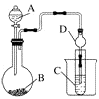
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示。放电时总反应为Zn+2H2O+2MnO2![]() Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
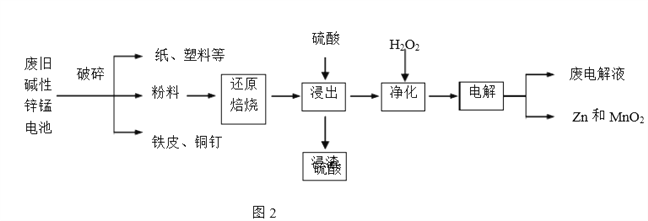
回答下列问题:
(1)碱性锌锰电池中,锌粉、MnO2、KOH的作用分别是(每空只选1个)_______、_______ 、______。
a.正极反应物b. 正极材料 c.负极反应物
d. 负极材料 e. 电子导体 f. 离子导体
(2)“还原焙烧”过程中,无需外加还原剂即可在焙烧过程中将MnOOH、MnO2还原为MnO,起还原作用的物质是___________。
(3)“净化”是在浸出液中先加入H2O2,再加入碱调节溶液pH到4.5左右,再过滤出沉淀。请完整说明这样操作的目的是______________。
Zn(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀的pH | 5.5 | 1.9 | 8.0 |
沉淀完全的pH | 8.0 | 3.2 | 10.0 |
(4) “电解”时,阳极的电极反应式为___。本工艺中应循环利用的物质是____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为_____。
(6)某碱性锌锰电池维持电流0.5 A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有____%的金属锌未参加反应。