题目内容
【题目】碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ/mol
C(石墨)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为____;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为_;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:_____;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是_____(填序号)
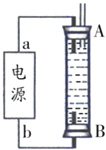
A.电源中的a一定为正极,b一定为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
H2O | CO | CO2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 0.4 | 3 |
3 | 900 | 1 | 2 | 0.4 | 1 |
①该反应的正反应为_____(填“吸”或“放”)热反应;
②实验2中,平衡常数K=_____;
③实验3跟实验2相比,改变的条件可能是_____(答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序_____.
【答案】Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-28.5kJ/mol PdCl2+CO+H2O=Pd+CO2+2HCl C3H8 +26OH-﹣20e-=3![]() +17H2O ABD 放热 16 使用了催化剂或增大了压强 c(Na+)>c(
+17H2O ABD 放热 16 使用了催化剂或增大了压强 c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
【解析】
(1)①根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;②根据氧化还原反应规律,写出反应的化学方程式;
(2)①根据负极电极反应式=总反应方程式﹣正极的电极反应式来解答;
(3)①比较第二组的第一组反应物的转化率大小以及温度对化学平衡和转化率的影响来判断;
②首先利用三段式计算出平衡时各物质的浓度,根据K=![]() 计算;
计算;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动;
(4)2.4g碳是0.2mol,燃烧生成0.2molCO2,与0.3molNaOH反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3+H2O,生成0.1molNa2CO3、0.1molNaHCO3,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,碳酸根离子水解大于碳酸氢根离子的水解,水解使溶液显碱性,以此来解答。
(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol ①
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol ②
由①﹣②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣28.5kJ/mol,故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣28.5kJ/mol,
②氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢,反应的化学方程式为:PdCl2+CO+H2O=Pd+CO2+2HCl,故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH﹣=3![]() +7H2O,正极发生还原反应,电极反应式为:O2+4e﹣+2H2O=4OH﹣,负极发生氧化反应,电极反应式为:C3H8 +26OH﹣﹣20e﹣=3
+7H2O,正极发生还原反应,电极反应式为:O2+4e﹣+2H2O=4OH﹣,负极发生氧化反应,电极反应式为:C3H8 +26OH﹣﹣20e﹣=3![]() +17H2O;故答案为:C3H8 +26OH﹣﹣20e﹣=3
+17H2O;故答案为:C3H8 +26OH﹣﹣20e﹣=3![]() +17H2O;
+17H2O;
②A.因为生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,电源中的a与A相连,则a为正极,b与B相连,则b为负极,选项A正确;
B.电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会在阳极失电子,所以选用NaCl溶液不影响实验,选项B正确;
C.阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,选项C错误;
D.阴极氢离子放电,其电极反应为2H++2e﹣=H2↑,选项D正确;
答案选ABD;
(3)①实验1中CO的转化率为1.6mol4mol×100%=40%,实验2中CO的转化率为0.4mol2mol×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,故答案为:放热;
②
根据K=![]() =
=![]() =16,故答案为:16;
=16,故答案为:16;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动,应是使用了催化剂,又由于反应前后气体体积不变,则增大了压强,平衡也不移动,也可能为压强的增大,故答案为:使用了催化剂或增大了压强;
(4)2.4g碳是0.2mol,燃烧生成0.2molCO2,与0.3molNaOH反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3+H2O,生成0.1molNa2CO3、0.1molNaHCO3,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,c(Na+)最大,碳酸根离子水解大于碳酸氢根离子的水解,则c(![]() )>c(
)>c(![]() ),水解使溶液显碱性,则c(OH﹣)>c(H+),显性离子大于隐性离子,所以c(
),水解使溶液显碱性,则c(OH﹣)>c(H+),显性离子大于隐性离子,所以c(![]() )>c(
)>c(![]() )>c(OH﹣)>c(H+),即离子浓度大小为:c(Na+)>c(
)>c(OH﹣)>c(H+),即离子浓度大小为:c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH﹣)>c(H+),故答案为:c(Na+)>c(
)>c(OH﹣)>c(H+),故答案为:c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH﹣)>c(H+)。
)>c(OH﹣)>c(H+)。

 暑假作业海燕出版社系列答案
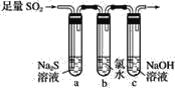
暑假作业海燕出版社系列答案【题目】煤燃烧排放的烟气含有SO2和NOx(主要成分为NO、NO2的混合物),对烟气进行脱硫、脱硝有多种方法。
(1)碱液吸收法:采用石灰乳脱除SO2.脱除后的主要产物是_____。
(2)液相氧化法:采用 NaClO溶液进行脱除。
①NaClO水解的离子方程式是_____。
②NaClO溶液吸收NO的主要过程如下
i.NO(aq)+HClO(aq)NO2(aq)+HCl(aq) △H1
ii.3NO2(aq)+H2O(1)2HNO3(aq)+NO(aq) △H2
NO(aq)转化为HNO3(aq)的热化学方程式是_____。
③研究pH对NO脱除率的影响。调节 NaClO溶液的初始pH,NO的脱除率如表:
初始pH | 3.5 | 4.5 | 5.5 | 6.5 | 7.5 |
NO脱除率 | 91% | 88% | 83% | 65% | 51% |
pH影响NO脱除率的原因是_____。
(3)研究发现,在液相氧化法中,一定量的SO2能提高NOx的脱除率。当pH=5.5时,SO2对有效氯含量、NOx脱除率的影响如图所示。

①据图1,通入SO2后有效氯含量降低。SO2和HClO反应的离子方程式是_____。
②针对图2中NOx脱除率提高的原因,研究者提出了几种可能发生的反应:
A.SO2+2NO+H2O═N2O+H2SO4
B.2SO2+2NO+2H2O═N2+2H2SO4
C.4SO2+2NO2+4H2O═N2+4H2SO4
用同位素示踪法确认发生的反应:把15NO2和NO按一定比例混合,通入SO2的水溶液中,检测气体产物。
a.气体产物中主要含有15NO2、N2O,则发生的主要反应是_____(填序号)。
b.同时检测到气体产物中还有15N N,产生15N N的化学方程式是_____。