��Ŀ����
����Ŀ����500��ʱ����4molSO2��2molO2����4L���ܱ������У�5���Ӻ�Ӧ�ﵽƽ�⣺2SO2��O2![]() 2SO3�����ƽ��ʱSO3��Ũ��Ϊ0.5mol��L��1��
2SO3�����ƽ��ʱSO3��Ũ��Ϊ0.5mol��L��1��
��1����500��ʱ���÷�Ӧƽ�ⳣ��K��_____
��2����Ӧ�ﵽƽ��ʱ��SO2��ת����Ϊ______
��3���ӿ�ʼ��Ӧ���ﵽƽ��״̬ ��Ӧ����v(O2)��_____
��4���÷�Ӧ�ڵ���ʱ���Է����У���÷�Ӧ������Ӧ��_____(��������������������)��Ӧ
��5����500��ʱ����2L���ܱ������У�����������Ӧ��ijһʱ�̲��������SO2��O2��SO3�����ʵ����ֱ�Ϊ1mol��2mol��2mol���ʱ���淴Ӧ���ʴ�СΪv(��)____v(��)��������������������������
���𰸡�4 50% 0.05 mol��L��1��min��1 ���� =
��������
��һ���¶��£���4molSO2��2molO2����4L���ܱ������У�c(SO3)=0.5mol/L����������ʽ������(1)~(3)��
(4)�÷�Ӧ����S��0���ڵ���ʱ���Է����У���Ҫ��G=��H-T��S��0���ݴ˷����жϣ�
(5)���ȼ���Qc������Qc��K�Ĵ�С��ϵ�����жϡ�
��һ���¶��£���4molSO2��2molO2����4L���ܱ������У�5���Ӻ�Ӧ��2SO2��O2![]() 2SO3�ﵽƽ�⣬c(SO3)=0.5mol/L����ת�������������ʵ���Ϊx����
2SO3�ﵽƽ�⣬c(SO3)=0.5mol/L����ת�������������ʵ���Ϊx����
2SO2 + O2![]() 2SO3
2SO3
��ʼ(mol) 4 2 0
ת��(mol) 2x x 2x
ƽ��(mol) 4-2x 2-x 2x
��c(SO3)=![]() =0.5mol/L����ã�x=1mol����ƽ����c(O2)=
=0.5mol/L����ã�x=1mol����ƽ����c(O2)=![]() =0.25mol/L��c(SO2)=
=0.25mol/L��c(SO2)=![]() =0.5mol/L��
=0.5mol/L��
(1)���¶���ƽ�ⳣ��K=![]() =4L/mol���ʴ�Ϊ��4L/mol(��4)��
=4L/mol���ʴ�Ϊ��4L/mol(��4)��
(2)ƽ��ʱSO2��ת����=![]() ��100%=50%���ʴ�Ϊ��50%��
��100%=50%���ʴ�Ϊ��50%��
(3)�ӿ�ʼ��Ӧ���ﵽƽ��״̬��ʱ��Ϊ5���ӣ�O2�ķ�Ӧ����v(O2)��![]() =0.05 mol/(L��nim)���ʴ�Ϊ��0.05 mol/(L��min)��
=0.05 mol/(L��nim)���ʴ�Ϊ��0.05 mol/(L��min)��
(4)�÷�Ӧ����S��0���ڵ���ʱ���Է����У�����G=��H-T��S��0������H��0���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���ʴ�Ϊ�����ȣ�
(5)�������£���Ӧ2SO2��O2![]() 2SO3��Qc=
2SO3��Qc=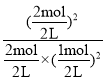 =4=K=4����˷�ӦΪƽ��״̬�����淴Ӧ���ʵ�������Ӧ���ʣ��ʴ�Ϊ��=��
=4=K=4����˷�ӦΪƽ��״̬�����淴Ӧ���ʵ�������Ӧ���ʣ��ʴ�Ϊ��=��

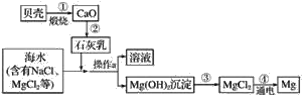
 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�����Ŀ��������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�
������Ͳ��ȡ50 mL 0.50 mol��L��1���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50 mL 0.55 mol��L��1 NaOH��Һ������ͬһ�¶ȼƲ�����¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶ȡ��ش��������⣺

��1����ͼ��������δ������������______��__________��
��2��Ϊʲô����NaOH��ҺҪ�Թ���_________________��
��3������NaOH��Һ����ȷ������_______________________��
��4���ֽ�һ������ϡ����������Һ��ϡ����������Һ��ϡ��ˮ�ֱ��1 L 1 mol��L��1��ϡ����ǡ����ȫ��Ӧ���䷴Ӧ�ȷֱ�Ϊ��H1����H2����H3������H1����H2����H3�Ĵ�С��ϵΪ______��
��5���������������������Һ���ܶȶ���1 g��cm��3����֪�кͷ�Ӧ��������Һ�ı�����c��4.18 J��g��1������1��Ϊ�˼����к��ȣ�ijѧ��ʵ���¼�������£�
ʵ�� ��� | ��ʼ�¶�t1/ �� | ��ֹ�¶�t2/ �� | |
���� | ����������Һ | �����Һ | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
���ݸ�ѧ����ʵ�����ݼ��㣬��ʵ���õ��к�����H��______(�������һλС��)��
��6��____(������������������)��Ba(OH)2��Һ�������������������Һ�����ᣬ������______��
����Ŀ����һ����������һ�ܱ������г���һ����CO2���壬�������������ۣ�������Ӧ��Fe(s)��CO2(g)![]() FeO(s)��CO(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
FeO(s)��CO(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
T/�� | 1200 | 1100 | 1000 | 900 | 800 |
K | 0.36 | 0.49 | 1.0 | 1.23 | 1.89 |
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��______��
��2���÷�ӦΪ______(��������������������)��Ӧ��
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������____��
A��������ѹǿ���� B�����������c(CO)����
C����������ƽ����Է����������� D��c(CO2)��c(CO)
��4�����д�ʩ�У��ܹ��ı�ƽ��ʱc(CO)/c(CO2)�ı�ֵ����_____(�����)��
A���¶� B�����۵���(����)
C��ѹǿ D��CO����
��5����900���£��÷�Ӧ�ﵽƽ��ʱ��CO2�����ʵ���Ũ��Ϊ2mol��L-1�����ʱc(CO)��____ mol��L-1