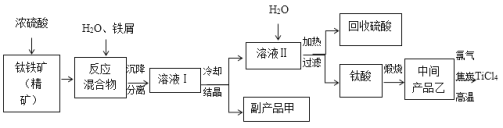
题目内容
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:

(1)该图中有两处未画出,它们是______、__________。
(2)为什么所用NaOH溶液要稍过量_________________。
(3)倒入NaOH溶液的正确操作是_______________________。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为______。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=______(结果保留一位小数)。
(6)____(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是______。
【答案】环形玻璃搅拌棒保温硬纸板确保盐酸被完全中和一次迅速倒入ΔH1=ΔH2<ΔH3-51.8 kJ·mol-1不能H2SO4与Ba(OH)2反应生成BaSO4沉淀,沉淀的生成热会影响反应的反应热
【解析】
(1)根据装置图,图中缺少环形玻璃搅拌棒和保温硬纸板,故答案为:环形玻璃搅拌棒;保温硬纸板;
(2)为了确保盐酸被完全中和,所用NaOH溶液要稍过量,故答案为:确保盐酸被完全中和;
(3)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,故答案为:一次迅速倒入;
(4)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和1L 1molL-1的稀盐酸恰好完全反应放热57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1L 1molL-1的稀盐酸恰好完全反应放热小于57.3kJ,反应焓变是负值,所以△H1=△H2<△H3;故答案为:△H1=△H2<△H3;
(5)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为:23.2℃,反应前后温度差为:3.15℃;第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.4℃,反应前后温度差为:3.1℃;第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应后温度为:23.6℃,反应前后温度差为:3.05℃;50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×![]() =12958J=1.2958kJ,即生成0.025mol的水放出热量为:1.2958kJ,所以生成1mol的水放出热量为1.2958kJ×
=12958J=1.2958kJ,即生成0.025mol的水放出热量为:1.2958kJ,所以生成1mol的水放出热量为1.2958kJ×![]() =51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJ/mol;
=51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol,故答案为:-51.8kJ/mol;
(6)硫酸与Ba(OH)2溶液反应除了生成水外,还生成了BaSO4沉淀,该反应中的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,故答案为:不能;H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案