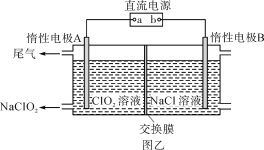
题目内容
【题目】下列事实不能用勒夏特列原理解释的是
A. 实验室可以用排饱和食盐水的方法收集氯气
B. 将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C. 高压有利于工业上合成氨
D. 打开汽水瓶时,瓶中立即泛起大量泡沫
【答案】B
【解析】
A、氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应:Cl2+H2O![]() HClO+H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可用勒夏特列原理解释,故A不选;
HClO+H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可用勒夏特列原理解释,故A不选;
B、将铜粉和锌粉混合后放入稀硫酸中,构成原电池,加快反应速率,不能用勒夏特列原理解释,故B选;
C、合成氨的正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,为提高NH3的产率,理论上应采取高压措施,所以能用勒夏特列原理解释,故C不选;
D、汽水瓶中存在平衡H2CO3![]() H2O+CO2,打开汽水瓶时,压强降低,平衡向生成二氧化碳方向移动,可以用勒夏特列原理解释,故D不选;
H2O+CO2,打开汽水瓶时,压强降低,平衡向生成二氧化碳方向移动,可以用勒夏特列原理解释,故D不选;
答案选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目