题目内容
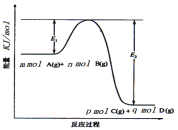
【题目】在一定条件,向一密闭容器中充入一定量CO2气体,并加入足量铁粉,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知该反应在不同温度下的平衡常数如下:
FeO(s)+CO(g),已知该反应在不同温度下的平衡常数如下:
T/℃ | 1200 | 1100 | 1000 | 900 | 800 |
K | 0.36 | 0.49 | 1.0 | 1.23 | 1.89 |
(1)该反应的化学平衡常数表达式为K=______。
(2)该反应为______(填“吸热”或“放热”)反应。
(3)能判断该反应是否达到化学平衡状态的依据是____。
A.容器中压强不变 B.混合气体中c(CO)不变
C.混合气体的平均相对分子质量不变 D.c(CO2)=c(CO)
(4)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是_____(填序号)。
A.温度 B.铁粉的量(足量)
C.压强 D.CO的量
(5)在900℃下,该反应达到平衡时,CO2的物质的量浓度为2mol·L-1,则此时c(CO)=____ mol·L-1
【答案】K=C(CO)/C(CO2) 放热 BC A 2.46
【解析】
(1)根据平衡常数的概念分析解答;
(2)根据表格数据,降低温度,平衡常数K增大,结合温度对平衡的影响分析判断;
(3)根据化学平衡状态的特征分析判断;
(4)改变平衡时c(CO)/c(CO2)的比值,说明平衡常数K发生了变化,据此分析判断;
(5)在900℃下,K=1.23,据此分析计算。
(1)Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数表达式为K=
FeO(s)+CO(g)的平衡常数表达式为K=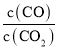 ,故答案为:K=
,故答案为:K=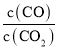 ;
;
(2)根据表格数据,降低温度,平衡常数K增大,说明降低温度,平衡正向移动,该反应为放热反应,故答案为:放热;
(3)对于反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)。
FeO(s)+CO(g)。
A.反应前后气体的物质的量不变,容器中压强始终不变,不能判断是否为平衡状态,故A错误;B.混合气体中c(CO)不变,说明正逆反应速率相等,反应达到平衡状态,故B正确;C.反应前后气体的物质的量不变,但质量减小,因此混合气体的平均相对分子质量不变,说明反应达到平衡状态,故C正确;D.只有1000℃时,达到平衡时存在c(CO2)=c(CO),但温度不一定是1000℃,因此不能判断是平衡状态,故D错误;故答案为:BC;
(4)能够改变平衡时c(CO)/c(CO2)的比值,即改变K。A.升高温度反应向吸热方向移动,则该比值一定发生变化,故A正确;B.Fe粉的量改变,不改变浓度,平衡不移动,则该比值不发生变化,故B错误;C.改变压强,平衡不移动,则该比值不发生变化,故C错误;D.CO的量改变,化学平衡移动,但温度不变,最终平衡常数K不变,所以c(CO)/c(CO2)的比值不变,故D错误;故答案为:A;
(5)在900℃下,K=1.23=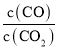 ,该反应达到平衡时,CO2的物质的量浓度为2mol·L-1,则此时c(CO)=K×c(CO2)=1.23×2mol·L-1=2.46mol·L-1,故答案为:2.46。
,该反应达到平衡时,CO2的物质的量浓度为2mol·L-1,则此时c(CO)=K×c(CO2)=1.23×2mol·L-1=2.46mol·L-1,故答案为:2.46。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色晶体,常用作催化剂和陶瓷着色剂,为确定其组成,某小组进行了实验探究。
(查阅资料)碱式碳酸镍300℃以上时分解生成3种氧化物。NiO为绿色粉末,Ni2O3为灰黑色固体。
(实验探究)选用下图所示部分装置进行实验(夹持装置略)
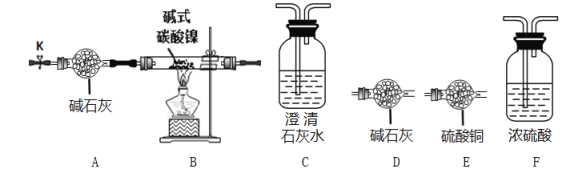
实验I定性探究:确定3种氧化物的组成。
(1)预测三种氧化物分别是含Ni、H、、C三种元素的理论依据是___________________。
(2)经检验生成的三种氧化物分别为NiO、H2O和CO2,装置连接顺序为AB__________(填装置的字母序号)。其中装置B现象为_________________。
实验II 定量确定碱式碳酸镍的组成。连接装置A-B-F-D-D进行实验。
实验步骤如下:
i 称量碱式碳酸镍、装置F、装置D(前一个)的质量并记录
ii 打开活塞K,缓缓通入空气
iii点燃酒精灯,加热
iv熄灭酒精灯, 冷却到室温, 关闭K
v 再次称量装置F、装置D(前一个)的质量并记录
(3)其中步骤ii的目的是_____________________________________。
(4)若缺少装置A将导致所测得的x值___________(填“偏大”或“偏小”或“无影响”)。
(5)重复操作ii-v至__________________________时,可判断碱式碳酸镍已完全分解。
(6)实验前测得石英玻璃管中的样品质量为3.77g,其他数据如下表所示
装置F质量/g | 装置D(前一个)质量/g | |
实验前 | 132.00 | 41.00 |
实验后 | 133.08 | 41.44 |
该碱式碳酸镍的化学式为____________________________________。
【题目】海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢就是抗腐蚀性能强的新型材料。
①基态Ni原子的电子排布式为________________,铬元素在周期表中____区。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有________ mol σ键。
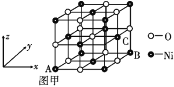
③NiO的晶体结构如图甲所示,其中离子坐标参数 A 为(0,0,0),B为(1,1,0),则C离子坐标参数为____。
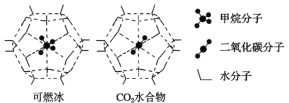
(2)海洋底部有储量丰富的可燃冰,一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能 E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的2种作用力是_____________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知如图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________________。
(3)①CH4和CO2所含的三种元素电负性从小到大的顺序为_______________
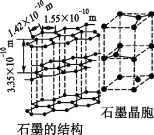
②碳的另一种同素异形体——石墨,其晶体结构如图所示,则石墨晶胞含碳原子个数为____个.已知石墨的密度为ρ g·cm—3,C—C键长为r cm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距为__________cm。
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g/cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~65℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)仪器D的名称为_____。
(2)①滴加酸性Na2Cr2O7溶液时反应的离子方程式为______________;
②蒸馏不能分离环己酮和水的原因是_____。
(3)环己酮需要经过以下操作提纯:
a.往液体中加入NaCl固体至饱和,静置,分液
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.加入无水MgSO4固体,除去有机物中少量的水
d.过滤
e.蒸馏、除去乙醚后,收集151~156℃馏分
①b中水层用乙醚萃取的目的是_____;
②上述操作a、d中使用的玻璃仪器除烧杯、玻璃棒外,还需要的玻璃仪器有____、___,操作a中,加入NaCl固体的作用是_____。
(4)恢复至室温时,分离得到纯产品体积为8mL,则环己酮的产率为____。(保留3位有效数字)