题目内容
向含有0.078mol FeSO4的溶液中通入201.6mL(标准状况)Cl2,再加入含有0.01mol X2O72-的溶液后,Fe2+恰好完全转化为Fe3+,则反应后X元素的化合价为( )
| A、+3 | B、+4 | C、+5 | D、+6 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:n(Cl2)=
=0.009mol,
0.078molFe2+被氧化为0.078molFe3+,失去0.078mol电子,利用电子守恒,0.009molCl2与0.01molX2O72-也应该得到0.078mol电子,令X在还原产物的化合价为a,根据电子转移守恒列放出计算a值.
| 0.2016L |
| 22.4L/mol |
0.078molFe2+被氧化为0.078molFe3+,失去0.078mol电子,利用电子守恒,0.009molCl2与0.01molX2O72-也应该得到0.078mol电子,令X在还原产物的化合价为a,根据电子转移守恒列放出计算a值.
解答:
解:n(Cl2)=
=0.009mol,
0.078molFe2+被氧化为0.078molFe3+,失去0.078mol电子,利用电子守恒,0.009molCl2与0.01molX2O72-也应该得到0.078mol电子,令X在还原产物的化合价为a,则:0.009mol×2+0.01mol×2×(6-a)=0.078mol,a=3,
则反应后X的化合物为+3价,
故选A.
| 0.2016L |
| 22.4L/mol |
0.078molFe2+被氧化为0.078molFe3+,失去0.078mol电子,利用电子守恒,0.009molCl2与0.01molX2O72-也应该得到0.078mol电子,令X在还原产物的化合价为a,则:0.009mol×2+0.01mol×2×(6-a)=0.078mol,a=3,
则反应后X的化合物为+3价,
故选A.
点评:本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,注意理解电子转移守恒的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有关3BrF3+5H2O═HBrO3+Br2+9HF+O2↑反应的叙述,正确的是( )
| A、还原剂与氧化剂的物质的量之为5:3 |
| B、HBrO3和HF是还原产物 |
| C、生成1mol O2,5mol H2O被氧化 |
| D、BrF3既是氧化剂又是还原剂 |
以下有关氨及铵盐的叙述中,不正确的是( )
| A、可以用浓氨水加热制取氨气 |
| B、铵态氮肥不能与碱性物质如草木灰混合施用 |
| C、氨的喷泉实验体现了氨的溶解性和氧化性 |
| D、氨具有还原性,一定条件下可与氧化性的物质如氧气发生反应 |
将金属钠分别投入下列物质的水溶液中,产生气体和蓝色沉淀的是( )
| A、NaCl |
| B、K2SO4 |
| C、CuCl2 |
| D、MgCl2 |
研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的应该是( )
| A、青菜中含有维生素C |
| B、维生素C具有还原性 |
| C、致人中毒过程中砷发生还原反应 |
| D、砒霜是氧化产物 |
关于溶液的下列说法正确的是( )
| A、用湿润的pH试纸测稀碱液的pH,测定值偏大 |
| B、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| C、已知:H2B?H++HB-,HB-?H++B2-(电离常数K1=1.3×10-7,K2=7.1×10-15),则NaHB溶液显酸性 |
| D、除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
下列物质中,水解的最终产物含有葡萄糖的是( )
| A、油脂 | B、蛋白质 | C、蔗糖 | D、酶 |
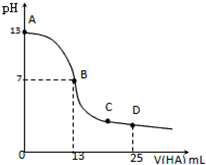 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).下列说法错误的是( )
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).下列说法错误的是( )| A、MOH的电离方程式为MOH=M++OH- |
| B、MOH与HA恰好完全反应时,溶液呈碱性,理由是A-+H2O=HA+OH-;此时,混合溶液中由水电离出的c(H+)大于0.2mol/L HA溶液中由水电离出的c(H+) |
| C、混合溶液中在B点:c(M+)=c(A-)>c(H+)=c(OH-);在C点:c(A-)>c(M+)>c(H+)>c(OH-) |
| D、溶液中D点时 c(A-)+c(HA)=2c(M+);若此时测得pH=3,则c(HA)+c(H+)=0.05+10-11mol/L |