题目内容
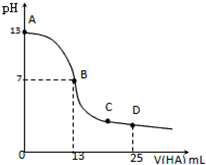 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).下列说法错误的是( )
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).下列说法错误的是( )| A、MOH的电离方程式为MOH=M++OH- |
| B、MOH与HA恰好完全反应时,溶液呈碱性,理由是A-+H2O=HA+OH-;此时,混合溶液中由水电离出的c(H+)大于0.2mol/L HA溶液中由水电离出的c(H+) |
| C、混合溶液中在B点:c(M+)=c(A-)>c(H+)=c(OH-);在C点:c(A-)>c(M+)>c(H+)>c(OH-) |
| D、溶液中D点时 c(A-)+c(HA)=2c(M+);若此时测得pH=3,则c(HA)+c(H+)=0.05+10-11mol/L |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.由图象可知0.1mol/L MOH溶液的pH=13,c(OH-)=0.1mol/L,说明为强碱,完全电离;
B.由图象可知,当加入13mL0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸;二者恰好反应,应生成强碱弱酸盐,促进水的电离;
C.B点溶液呈中性;C点反应已进行完全,HA过量,溶液呈酸性,但MA的物质的量大于HA的物质的量,结合电荷守恒判断;
D.结合混合液中电荷守恒和物料守恒进行解答溶液中离子浓度大小,注意浓度的单位.
B.由图象可知,当加入13mL0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸;二者恰好反应,应生成强碱弱酸盐,促进水的电离;
C.B点溶液呈中性;C点反应已进行完全,HA过量,溶液呈酸性,但MA的物质的量大于HA的物质的量,结合电荷守恒判断;
D.结合混合液中电荷守恒和物料守恒进行解答溶液中离子浓度大小,注意浓度的单位.
解答:
解:A.由图象可知0.1mol/L MOH溶液的pH=13,c(OH-)=0.1mol/L,说明为强碱,完全电离,则电离方程式为:MOH═M++OH-,故A正确;
B.根据图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,水解呈碱性,发生A-+H2O?HA+OH-,促进水的电离,则混合溶液中由水电离出的c(H+)大于0.2mol/L HA溶液中由水电离出的c(H+),故B正确;
C.B点溶液呈中性,溶液中存在c(M+)=c(A-)>c(H+)=c(OH-),C点反应已进行完全,HA过量,溶液呈酸性,但MA的物质的量大于HA的物质的量,应存在c(A-)>c(M+)>c(H+)>c(OH-),故C正确;
D.D点时,加入n(HA)=0.005mol,而加入n(MOH)=0.0025mol,A元素以A-和HA两种形式存在,而M全以M+形式存在,溶液中c(A-)+c(HA)=2c(M+);c(M+)=0.05mol/L,c(OH-)=1×10-11mol/L,由电荷守恒c(M+)+c(H+)=c(A-)+c(OH-)和物料守恒c(A-)+c(HA)=2c(M+),求得c(HA)+c(H+)=c(M+)+c(OH-)=0.05mol/L+10-11mol/L,浓度必须带上单位,故D错误;
故选D.
B.根据图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,水解呈碱性,发生A-+H2O?HA+OH-,促进水的电离,则混合溶液中由水电离出的c(H+)大于0.2mol/L HA溶液中由水电离出的c(H+),故B正确;
C.B点溶液呈中性,溶液中存在c(M+)=c(A-)>c(H+)=c(OH-),C点反应已进行完全,HA过量,溶液呈酸性,但MA的物质的量大于HA的物质的量,应存在c(A-)>c(M+)>c(H+)>c(OH-),故C正确;
D.D点时,加入n(HA)=0.005mol,而加入n(MOH)=0.0025mol,A元素以A-和HA两种形式存在,而M全以M+形式存在,溶液中c(A-)+c(HA)=2c(M+);c(M+)=0.05mol/L,c(OH-)=1×10-11mol/L,由电荷守恒c(M+)+c(H+)=c(A-)+c(OH-)和物料守恒c(A-)+c(HA)=2c(M+),求得c(HA)+c(H+)=c(M+)+c(OH-)=0.05mol/L+10-11mol/L,浓度必须带上单位,故D错误;
故选D.
点评:本题考查了酸碱混合溶液定性判断、溶液中离子浓度大小比较,题目难度中等,试题侧重于学生的分析能力的考查,为高考常见题型,明确图象中各个点的含义是解本题关键,结合电荷守恒、物料守恒判断溶液中离子浓度大小,选项D为易错点,注意浓度的单位为mol/L.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
下列化学用语书写不正确的是( )
A、甲烷的电子式: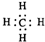 | ||
B、氟化钠的电子式: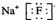 | ||
| C、硫离子的电子式:S2- | ||
D、碳-12原子:
|
向含有0.078mol FeSO4的溶液中通入201.6mL(标准状况)Cl2,再加入含有0.01mol X2O72-的溶液后,Fe2+恰好完全转化为Fe3+,则反应后X元素的化合价为( )
| A、+3 | B、+4 | C、+5 | D、+6 |
现有ag CH4在足量的氧气中充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
| A、a g | B、1.5a g |
| C、2a g | D、2.5a g |
检验氯化氢气体中是否混有Cl2可采用的方法是( )
| A、用湿润的蓝色石蕊试纸 |
| B、用干燥有色布条 |
| C、用湿润的淀粉碘化钾试纸 |
| D、将气体通入硝酸银溶液 |
某陨石中含有镁的一种放射性同位素
Mg,下列对其描述正确的是( )
28 12 |
| A、中子数28 |
| B、核电荷数12 |
| C、电子数28 |
| D、中子数与质子数之差16 |