题目内容
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO.
(1)Ca元素在周期表中的位置是 ,其原子结构示意图为 .
(2)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为 ;
(3)配平用钙线脱氧脱磷的化学方程式: P+ FeO+ CaO
Ca3(PO4)2+ Fe
(4)上述反应每生成1molCa3(PO4)2,有 mol电子转移.
(5)用1.6g钙线试样,与水充分反应,生成224mL H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3 g.
(1)Ca元素在周期表中的位置是
(2)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为
(3)配平用钙线脱氧脱磷的化学方程式:
| ||
(4)上述反应每生成1molCa3(PO4)2,有
(5)用1.6g钙线试样,与水充分反应,生成224mL H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3
考点:位置结构性质的相互关系应用,化学方程式的有关计算,元素周期表的结构及其应用,氧化还原反应方程式的配平
专题:计算题,元素及其化合物
分析:(1)Ca是20号元素,钙原子核外电子数为20,有3个电子层,各层电子数为2、8、8、1,对于主族元素,电子层数=周期数,最外层电子数=族序数;
(2)生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,应为Fe(OH)2→Fe(OH)3的转化;
(3)反应中P磷元素的化合价由0价升高为+5价,总共升高10价,铁元素化合价由+2价降低为0价,总共降低2价,化合价升高最小公倍数为10,据此配平;
(4)根据P元素化合价的变化判断;
(5)钙与水反应生成氢氧化钙与氢气,根据n=
计算氢气的物质的量,根据电子转移守恒计算Ca的物质的量,根据氧化钙的质量分数计算氧化钙的质量,计算氧化钙的物质的量,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO),再根据m=nM计算碳酸钙的质量.
(2)生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色,应为Fe(OH)2→Fe(OH)3的转化;
(3)反应中P磷元素的化合价由0价升高为+5价,总共升高10价,铁元素化合价由+2价降低为0价,总共降低2价,化合价升高最小公倍数为10,据此配平;
(4)根据P元素化合价的变化判断;
(5)钙与水反应生成氢氧化钙与氢气,根据n=
| V |
| Vm |
解答:
解:(1)Ca是20号元素,钙原子核外电子数为20,有3个电子层,各层电子数为2、8、8、1,处于周期表中第四周期第ⅡA族,原子结构示意图为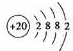 ,故答案为:第四周期第ⅡA族;
,故答案为:第四周期第ⅡA族; ;
;
(2)钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,M为Fe元素,故答案为:Fe;
(3)反应中P磷元素的化合价由0价升高为+5价,总共升高10价,铁元素化合价由+2价降低为0价,总共降低2价,化合价升高最小公倍数为10,故Ca3(PO4)2系数为1,FeO的系数为5,P系数为2,CaO的系数为3,Fe的系数为5,故配平后方程式为2P+5FeO+3CaO=Ca3(PO4)2+5Fe,故答案为:2; 5;3;1; 5;
(4)反应的方程式为2P+5FeO+3CaO=Ca3(PO4)2+5Fe,由方程式可知反应中P元素化合价由0价升高到+5价,可知每生成1molCa3(PO4)2,有10mol电子转移,
故答案为:10;
(5)224mlH2的物质的量为
=0.01mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为
=0.01mol,样品中CaO质量分数为3.5%,故氧化钙的质量为1.6g×3.5%=0.056g,故氧化钙的物质的量为
=0.001mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.01mol+0.001mol=0.011mol,碳酸钙的质量为0.011mol×100g/mol=1.1g,
故答案为:1.1.
 ,故答案为:第四周期第ⅡA族;
,故答案为:第四周期第ⅡA族; ;
;(2)钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,M为Fe元素,故答案为:Fe;
(3)反应中P磷元素的化合价由0价升高为+5价,总共升高10价,铁元素化合价由+2价降低为0价,总共降低2价,化合价升高最小公倍数为10,故Ca3(PO4)2系数为1,FeO的系数为5,P系数为2,CaO的系数为3,Fe的系数为5,故配平后方程式为2P+5FeO+3CaO=Ca3(PO4)2+5Fe,故答案为:2; 5;3;1; 5;
(4)反应的方程式为2P+5FeO+3CaO=Ca3(PO4)2+5Fe,由方程式可知反应中P元素化合价由0价升高到+5价,可知每生成1molCa3(PO4)2,有10mol电子转移,
故答案为:10;
(5)224mlH2的物质的量为
| 0.224L |
| 22.4L/mol |
| 0.01mol×2 |
| 2 |
| 0.056g |
| 56g/mol |
故答案为:1.1.
点评:本题考查结构与位置关系、常用化学用语书写、氧化还原反应、化学计算等,题目综合性较大,难度中等,(5)中注意利用守恒进行计算.

练习册系列答案
相关题目
向含有0.078mol FeSO4的溶液中通入201.6mL(标准状况)Cl2,再加入含有0.01mol X2O72-的溶液后,Fe2+恰好完全转化为Fe3+,则反应后X元素的化合价为( )
| A、+3 | B、+4 | C、+5 | D、+6 |
某陨石中含有镁的一种放射性同位素
Mg,下列对其描述正确的是( )
28 12 |
| A、中子数28 |
| B、核电荷数12 |
| C、电子数28 |
| D、中子数与质子数之差16 |
下列离子方程式书写不正确的是( )
| A、NaHCO3溶液与过量的Ca(OH)2溶液反应:HCO3-+OH-+Ca2+=CaCO3↓+H2O |
| B、向1mol AlCl3溶液中加入2mol NaOH:Al3++4OH-=AlO2-+2H2O |
| C、铜片插入氯化铁溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| D、少量CO2通入NaOH溶液中:CO2+2OH-=CO32-+H2O |