题目内容
11. 铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系(图1所示):请回答下列问题:
铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系(图1所示):请回答下列问题:(1)①下列有关铁元素的叙述中正确的是BD;
A.铁元素位于周期表第四周期第ⅧB族
B.亚硝酸盐中毒的原理是与血红蛋白中的铁元素作用,可用美蓝解毒,解毒过程中铁元素发生了还原反应
C.现代工业的炼铁高炉中,作还原剂的主要是碳
D.密封放在蒸馏水中的铁比空气中的铁生锈慢
②常温下,往H2O2的水溶液中加入少量FeSO4,可加快其分解速率,其中一个反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,则另一个离子方程式为2Fe3++H2O2=2Fe2++O2↑+2H+.
(2)①某同学在实验研究NaAlO2性质时,往其中加入NaHCO3溶液时发现只有白色沉淀生成,溶液混合时发生的离子方程式为H2O+HCO3-+AlO2-═CO32-+Al(OH)3↓.
②铝-空气电池是目前最有发展前景的电池,如图2为基本原理.请写出负极发生的电极反应式Al-3e-=Al3+.
(3)①空气中直接加热CuCl2•2H2O晶体得到的是CuO,如何通过合理的方法由CuCl2•2H2O晶体得到纯的无水CuCl2在HCl气流中加热失水.
②有人认为,将CuO还原得到的产物Cu中可能会含有Cu2O,请设计实验证明之取样后加H2SO4,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O(已知:Cu2O+2H+=Cu+Cu2++H2O)
分析 (1)①A.Fe的原子序数为26,处于第四周期Ⅷ族,是一种过渡金属;
B.解毒时铁元素由三价变为二价,被还原;
C.主要还原剂为CO气体;
D.铁生锈是铁与空气中的水和氧气共同作用的结果;
②铁离子在双氧水的分解中起到了催化剂的作用,据此分析另一个反应;
(2)①碳酸氢钠能电离出氢离子,氢离子和偏铝酸钠反应生成氢氧化铝沉淀,符合强酸制取弱酸;
②铝在原电池中做负极失电子生成铝离子;
(3)①铜离子发生水解生成易挥发的氯化氢,导致最终得到的是氧化铜,若在氯化氢气流中加热,则抑制了铜离子的水解,可以得到纯净的氯化铜;
②要判断产物中是否含有Cu2O,可加入稀硫酸检验溶液是否变蓝.
解答 解:(1)①A.铁为过渡金属元素,原子序数为26,在元素周期表中处于第四周期Ⅷ族,故A错误;
B.解毒时铁离子被还原为亚铁离子,发生还原反应,故B正确;
C.焦炭在高炉中转化成CO,CO为主要的还原剂,故C错误;
D.密封放在蒸馏水中的铁,由于没有氧气,则不易被腐蚀,故密封放在蒸馏水中的铁比空气中的铁生锈慢,故D正确;
故答案为:BD;
②常温下,往H2O2溶液中滴加少量FeSO4溶液,铁离子在双氧水的分解中起到催化作用,已知发生了反应:2Fe2++H2O2+2H+=2Fe3++2H2O,另一个反应则铁离子转化成亚铁离子,反应方程式为:2Fe3++H2O2=2Fe2++O2↑+2H+,
故答案为:2Fe3++H2O2=2Fe2++O2↑+2H+;
(2)①碳酸氢钠能电离出氢离子,氢离子和偏铝酸钠反应生成碳酸钠和氢氧化铝,反应离子方程式为:H2O+HCO3-+AlO2-═CO32-+Al(OH)3↓,
故答案为:H2O+HCO3-+AlO2-═CO32-+Al(OH)3↓,
②分析装置图可知,铝在原电池中做负极失电子生成铝离子,电极反应为:Al-3e-=Al3+,
故答案为:Al-3e-=Al3+;
(3)①直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是氯化铜水解生成的盐酸易挥发,需要通入氯化氢气流抑制铜离子的水解,则由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法为:在HCl气流中加热CuCl2•2H2O晶体,
故答案为:在HCl气流中加热失水;
②根据反应Cu2O+2H+=Cu+Cu2++H2O可知,要判断产物中是否含有Cu2O,可加入稀硫酸检验溶液是否变蓝,操作方法为:取样后加H2SO4,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O,
故答案为:取样后加H2SO4,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O.
点评 本题考查了金属单质及其化合物的综合应用,题目难度中等,涉及原子结构与元素周期表的关系、电解原理、金属的腐蚀、盐的水解原理及其应用、性质实验方案的设计等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | D、E以原子个数比2:1形成的化合物,只含离子键 | |
| B. | 元素A、B、C的单质晶体可能属于同种类型的晶体,也可能是不同类型的晶体.如果B在A2B7CD分子中有四种不同的环境,则该分子不能与硫酸反应 | |
| C. | 含E的某种离子的水溶液,滴加某种含A、C或A、C、D元素组成的离子的溶液,均可生成配合物 | |
| D. | B与C形成的化合物其沸点一定高于A与B形成的化合物 |
| A. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| B. | 用氢氧化铁胶体进行电泳实验时,阴极区域颜色加深,说明氢氧化铁胶体带正电荷 | |
| C. | 含Fe元素的质量分数为70%的铁红一定是纯净物 | |
| D. | 在干冰晶体中,每个CO2分子周围与之最接近而且距离相等的CO2分子有6个 |
| A. | 可燃冰是可以燃烧的冰 | |
| B. | 明矾的化学式:KAl(SO4)2 | |
| C. | 酒精、水玻璃、福尔马林都是非电解质 | |
| D. | 肽键是蛋白质一级结构中的主键 |
| A. | 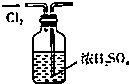 干燥Cl2 干燥Cl2 | B. |  吸收HCl | C. | 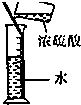 稀释浓H2SO4 | D. | 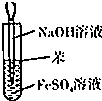 制取Fe(OH)2沉淀 |
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
(2)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:HR>YH4
c.Y与R形成的化的中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是0.099nm<r(Si)<0.143nm.
(4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是NaAlO2或Na2SiO3.
(5)已知单质X的燃烧热为296kJ/mo1,1mo1XM2(g)被氧化为1mo1XM3(g)的△H=-99kJ/mo1.写出由XM2生成XM3的热化学反应方程式2SO2(g)+O2=2SO3(g)△H=-198kJ/mol,计算由X(s)生成3mo1XM3(g)的△H=-1185kJ/mol.
| A. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| B. | S(s)+O2═SO2(g);△H1 S(g)+O2═SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 由苯制硝基苯 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用SiO2制备高纯硅 |



 ,其反应类型是消去反应.
,其反应类型是消去反应. .
.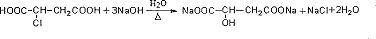 .
. .
.