题目内容
15.以下反应最符合绿色化学原子经济性要求的是( )| A. | 乙烯聚合为聚乙烯高分子材料 | B. | 由苯制硝基苯 | ||
| C. | 以铜和浓硝酸为原料生产硝酸铜 | D. | 用SiO2制备高纯硅 |
分析 “绿色化学”原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,常见的加成反应和加聚反应符合要求.
解答 解:A.乙烯聚合为聚乙烯高分子材料,反应物全部转化为产物,原料利用率为100%,故A正确;
B.由苯制硝基苯,属于取代反应,有副产品水生成,反应物没全部转化为所需产物,故B错误;
C.以铜和浓硝酸为原料生产硝酸铜,因有有毒气体二氧化氮生成,反应物没全部转化为所需产物,故C错误;
D.用SiO2制备高纯硅,反应中有副产物CO生成,反应物没全部转化为所需产物,故D错误.
故选A.
点评 本题考查“绿色化学”知识,难度不大,要熟悉各种反应类型,还要考虑环保、经济等方面.

练习册系列答案
相关题目
3.下列说法中正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 组成单质的分子内一定含有共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
4.常温下,0.1mol•L-1下列溶液的pH<7的是( )
| A. | CuSO4 | B. | 氨水 | C. | NaNO3 | D. | NaHCO3 |
5.下列有关化学用语表示正确的是( )
| A. | 四氯化碳分子比例模型: | B. | COS的电子式是: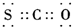 | ||
| C. | 次氯酸的结构式为H-Cl-O | D. | ${\;}_{8}^{18}$O2-离子结构示意图: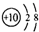 |
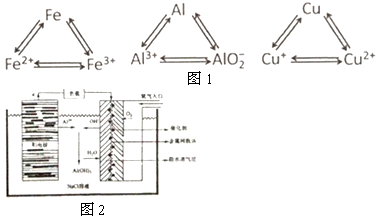 铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系(图1所示):请回答下列问题:
铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系(图1所示):请回答下列问题: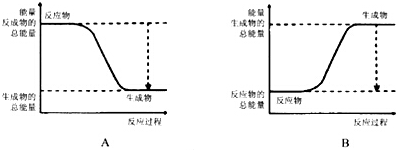 根据化学反应与能量转化的相关知识,试回答下列问题:
根据化学反应与能量转化的相关知识,试回答下列问题:
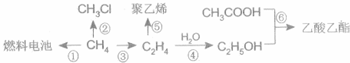
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
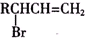
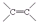 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷. ;
;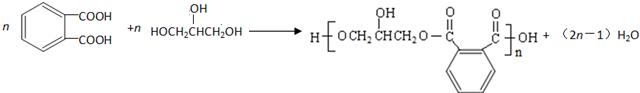 .
. 的同分异构体的结构简式
的同分异构体的结构简式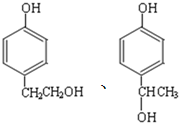 .
.