题目内容
19.下列说法正确的是( )| A. | 可燃冰是可以燃烧的冰 | |
| B. | 明矾的化学式:KAl(SO4)2 | |
| C. | 酒精、水玻璃、福尔马林都是非电解质 | |
| D. | 肽键是蛋白质一级结构中的主键 |
分析 A.可燃冰为甲烷和水形成的一种化合物;
B.明矾为十二水合硫酸铝钾,带有结晶水;
C.福尔马林为甲醛的水溶液,属于混合物,不属于非电解质;
D.氨基酸分子之间通过缩合反应形成肽键,肽键是蛋白质一级结构中的主键.
解答 解:A.可燃冰为甲烷和水形成的一种特殊的化合物,并不是可燃烧的冰,故A错误;
B.明矾含有12个结晶水,明矾的化学式为:KAl(SO4)2•12H2O,故B错误;
C.酒精、水玻璃都属于非电解质,而福尔马林是甲醛的水溶液,为混合物,不属于非电解质,故C错误;
D.蛋白质是由C、H、O、N、P、S等多种元素组成的复杂化合物,它是多个氨基酸通过缩合得到的,所以肽键是蛋白质一级结构中的主键,故D正确;
故选D.
点评 本题考查了较为综合,涉及化学式、电解质与非电解质、蛋白质的结构等知识,题目难度中等,注意掌握蛋白质的性质、电解质与非电解质的概念、常见化学用语的书写原则等知识,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
9.下列说法正确的是( )
| A. | 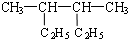 的名称是2,3-二甲基己烷 的名称是2,3-二甲基己烷 | |
| B. | 有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O | |
| C. | 有机物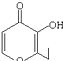 的一种芳香族同分异构体能发生银镜反应 的一种芳香族同分异构体能发生银镜反应 | |
| D. | 反应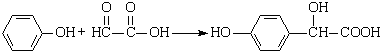 属于加成反应,理论上该反应的原子利用率为100% 属于加成反应,理论上该反应的原子利用率为100% |
10.(1)用分液漏斗、锥形瓶、导管、注射器、双孔胶塞、秒表和铁架台可以(选填“可以”、“不可以”)测定锌和稀硫酸反应生成氢气的反应速率
(2)为证明盐的水解是吸热反应,四位学生分别设计了如下实验方案,其中正确的是甲乙
甲.在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应
乙.用等浓度纯碱溶液去油污,热溶液比冷溶液效果好,说明盐类水解是吸热反应
丙.将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
丁.在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
(3)用标准NaOH溶液滴定未知浓度的盐酸溶液,下列操作造成测定结果偏高的是BC
A.酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗
B.滴定前,碱式滴定管尖嘴有气泡,滴定后气泡消失
C.滴定终点读数时,仰视定管刻度,其他操作正确
(4)用物质的量浓度为0.1000mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,分别取20.00mL 草酸溶液于3个洁净的锥形瓶,用标准的KMnO4(H+)溶液滴定至终点,数据如表:
已知:相关反应方程式为:5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
①标准KMnO4溶液应装在酸式(选填“酸式”或“碱式”)滴定管中;
②判断已达滴定终点的现象是:当滴下最后一滴标准溶液,溶液由无色变为浅紫色,且在30秒内不褪去;
③实验测得草酸溶液的物质的量浓度为0.2500mol/L.(保留四位有效数字)
(2)为证明盐的水解是吸热反应,四位学生分别设计了如下实验方案,其中正确的是甲乙
甲.在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应
乙.用等浓度纯碱溶液去油污,热溶液比冷溶液效果好,说明盐类水解是吸热反应
丙.将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
丁.在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
(3)用标准NaOH溶液滴定未知浓度的盐酸溶液,下列操作造成测定结果偏高的是BC
A.酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗
B.滴定前,碱式滴定管尖嘴有气泡,滴定后气泡消失
C.滴定终点读数时,仰视定管刻度,其他操作正确
(4)用物质的量浓度为0.1000mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,分别取20.00mL 草酸溶液于3个洁净的锥形瓶,用标准的KMnO4(H+)溶液滴定至终点,数据如表:
| 测定次数 | 第一次 | 第二次 | 第三次 |
| 初始读数(mL) | 0.40 | 0.90 | 0.00 |
| 终点读数(mL) | 25.05 | 21.00 | 19.90 |
请回答下列问题:
①标准KMnO4溶液应装在酸式(选填“酸式”或“碱式”)滴定管中;
②判断已达滴定终点的现象是:当滴下最后一滴标准溶液,溶液由无色变为浅紫色,且在30秒内不褪去;
③实验测得草酸溶液的物质的量浓度为0.2500mol/L.(保留四位有效数字)
7.M、N、X、Y四种物质之间有如下转化关系(反应条件和其它产物已略去).下列选项不符合的是( )
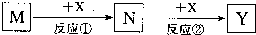
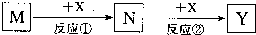
| A. | M:MaOH X:CO2 | B. | M:HNO3 X:Fe | C. | M:S X:O2 | D. | M:Al X:NaOH |
14.下列关于化学观或化学研究方法的叙述中,错误的是( )
| A. | 为防止水体富营养化.必须控制富含氮、磷污水的排放 | |
| B. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| C. | 根据元索周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 | |
| D. | 汽车尾气中产生NO的原因是空气中的N2与O2在汽车汽缸内的高温环境下发生反应产生的 |
4.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况屯的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 在上述五种元素形成的单质中,X元素可形成几种同素异形体 | |
| C. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定没有离子键 |
2.现有下列十种物质:①H2;②铜;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;
⑦红褐色的氢氧化铁液体; ⑧氨水;⑨稀硝酸;⑩Al2(SO4)3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是2:3,当有3.2g Cu发生反应时,转移电子的物质的量为0.1mol.该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
⑦红褐色的氢氧化铁液体; ⑧氨水;⑨稀硝酸;⑩Al2(SO4)3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 酸性氧化物 | 碱性氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是2:3,当有3.2g Cu发生反应时,转移电子的物质的量为0.1mol.该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
3.下列说法中正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 组成单质的分子内一定含有共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
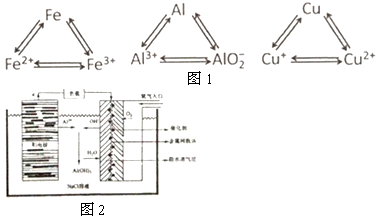 铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系(图1所示):请回答下列问题:
铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系(图1所示):请回答下列问题: