题目内容
1.有A、B、C、D、E五种元素,A与C同周期,B、C、D、E原子的电子层数各不相同.A是自然界中组成物质种类最多的元素;B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍;C是生命的基础,在生命活动中扮演十分重要的角色;D原子的次外层电子数是其最外层电子数与倒数第三层电子数之和,在火山附近的温泉中含有D元素;“天石”中含E的单质,但通常使用的E单质常含A元素.下列说法正确的是( )| A. | D、E以原子个数比2:1形成的化合物,只含离子键 | |
| B. | 元素A、B、C的单质晶体可能属于同种类型的晶体,也可能是不同类型的晶体.如果B在A2B7CD分子中有四种不同的环境,则该分子不能与硫酸反应 | |
| C. | 含E的某种离子的水溶液,滴加某种含A、C或A、C、D元素组成的离子的溶液,均可生成配合物 | |
| D. | B与C形成的化合物其沸点一定高于A与B形成的化合物 |
分析 A是自然界中组成物质种类最多的元素,应为C元素;B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,则B1中没有中子,故B为H元素;C是生命的基础,在生命活动中扮演十分重要的角色,应为N元素;D原子的次外层电子数是其最外层电子数与倒数第三层电子数之和,在火山附近的温泉中含有D元素,D为S元素;“天石”中含E的单质,但通常使用的E单质常含A元素,E应为Fe元素,合金中常含有C元素,以此解答该题.
解答 解:A是自然界中组成物质种类最多的元素,应为C元素;B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,则B1中没有中子,故B为H元素;C是生命的基础,在生命活动中扮演十分重要的角色,应为N元素;D原子的次外层电子数是其最外层电子数与倒数第三层电子数之和,在火山附近的温泉中含有D元素,D为S元素;“天石”中含E的单质,但通常使用的E单质常含A元素,E应为Fe元素,合金中常含有C元素,
A.D、E以原子个数比2:1形成的化合物为FeS2,含有离子键和共价键,故A错误;
B.C2H7NS分子有四种不同的环境,应为CH2(SH)CH2NH2,含有氨基,可与硫酸反应,故B错误;
C.含有Fe3+的化合物可与KSCN或KCN发生络合反应,故C正确;
D.A与B形成的化合物可为烃,如含C原子数较多,则常温下为固体,沸点较高,故D错误.
故选C.
点评 本题考查位置结构性质关系综合应用,明确元素种类是解题关键,注意原子结构以及物质的性质,难度不大,有利于基础知识的巩固.

练习册系列答案
相关题目
17.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol/L,用石墨作电极电解此溶液,当通电一段时间后(假设溶液体积不变),两极均收集到22.4L气体(标准状况).下列说法正确的是( )
| A. | 上述电解过程中铜转移2mol电子 | B. | 电解后溶液中c(H+)为4mol/L | ||
| C. | 电解得到的Cu的物质的量为0.5mol | D. | 原混合溶液中c(K+)为1mol/L |
12.常温时,下列叙述正确的是( )
| A. | 稀释pH=3的醋酸,溶液中所有离子的浓度均降低 | |
| B. | 一定浓度的CH3COOH和NaOH混合,溶液呈中性,则混合液中c(H +)=$\sqrt{{K}_{W}}$mol/L | |
| C. | pH均为11的NaOH和Na2CO3溶液中,水的电离程度相同 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
9.下列说法正确的是( )
| A. |  的名称是2,3-二甲基己烷 的名称是2,3-二甲基己烷 | |
| B. | 有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O | |
| C. | 有机物 的一种芳香族同分异构体能发生银镜反应 的一种芳香族同分异构体能发生银镜反应 | |
| D. | 反应 属于加成反应,理论上该反应的原子利用率为100% 属于加成反应,理论上该反应的原子利用率为100% |
13.下列有关物质用途的说法中错误的是( )
| A. | 自来水厂常用氯气给自来水消毒 | |
| B. | 澄清石灰可用于水鉴别Na2CO3和NaHCO3溶液 | |
| C. | 合金的机械性能一般比组分金属好,但有可能更加容易被腐蚀 | |
| D. | 加碘盐是在食盐中加入一定量的碘酸钾,以确保人体对碘的摄入量,可预防甲状腺肿大 |
10.(1)用分液漏斗、锥形瓶、导管、注射器、双孔胶塞、秒表和铁架台可以(选填“可以”、“不可以”)测定锌和稀硫酸反应生成氢气的反应速率
(2)为证明盐的水解是吸热反应,四位学生分别设计了如下实验方案,其中正确的是甲乙
甲.在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应
乙.用等浓度纯碱溶液去油污,热溶液比冷溶液效果好,说明盐类水解是吸热反应
丙.将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
丁.在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
(3)用标准NaOH溶液滴定未知浓度的盐酸溶液,下列操作造成测定结果偏高的是BC
A.酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗
B.滴定前,碱式滴定管尖嘴有气泡,滴定后气泡消失
C.滴定终点读数时,仰视定管刻度,其他操作正确
(4)用物质的量浓度为0.1000mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,分别取20.00mL 草酸溶液于3个洁净的锥形瓶,用标准的KMnO4(H+)溶液滴定至终点,数据如表:
已知:相关反应方程式为:5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
①标准KMnO4溶液应装在酸式(选填“酸式”或“碱式”)滴定管中;
②判断已达滴定终点的现象是:当滴下最后一滴标准溶液,溶液由无色变为浅紫色,且在30秒内不褪去;
③实验测得草酸溶液的物质的量浓度为0.2500mol/L.(保留四位有效数字)
(2)为证明盐的水解是吸热反应,四位学生分别设计了如下实验方案,其中正确的是甲乙
甲.在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应
乙.用等浓度纯碱溶液去油污,热溶液比冷溶液效果好,说明盐类水解是吸热反应
丙.将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应
丁.在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应
(3)用标准NaOH溶液滴定未知浓度的盐酸溶液,下列操作造成测定结果偏高的是BC
A.酸式滴定管用蒸馏水洗净后,未用待测盐酸润洗
B.滴定前,碱式滴定管尖嘴有气泡,滴定后气泡消失
C.滴定终点读数时,仰视定管刻度,其他操作正确
(4)用物质的量浓度为0.1000mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,分别取20.00mL 草酸溶液于3个洁净的锥形瓶,用标准的KMnO4(H+)溶液滴定至终点,数据如表:
| 测定次数 | 第一次 | 第二次 | 第三次 |
| 初始读数(mL) | 0.40 | 0.90 | 0.00 |
| 终点读数(mL) | 25.05 | 21.00 | 19.90 |
请回答下列问题:
①标准KMnO4溶液应装在酸式(选填“酸式”或“碱式”)滴定管中;
②判断已达滴定终点的现象是:当滴下最后一滴标准溶液,溶液由无色变为浅紫色,且在30秒内不褪去;
③实验测得草酸溶液的物质的量浓度为0.2500mol/L.(保留四位有效数字)
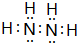 ,Z由两个相同基团构成,该基团的名称是羟基.
,Z由两个相同基团构成,该基团的名称是羟基.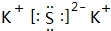 .
. 铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系(图1所示):请回答下列问题:
铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系(图1所示):请回答下列问题: