题目内容
6.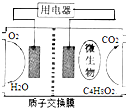 以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )
以油脂为燃料的微生物燃料电池是处理地沟油的理想方法.本题以乙酸乙酯替代油脂的生物燃料电池的结构如图所示.下列叙述正确的是( )| A. | 该电池能够在高温下工作 | |
| B. | 放电过程中,H+从左侧区向右侧区迁 | |
| C. | 负极反应为:C4H8O2+6H2O-20e-═4CO2↑+20H+ | |
| D. | 电池工作时右侧区域的pH将升高 |
分析 A、从蛋白质的性质分析;
B、放电时,阳离子向正极移动,所以氢离子向正极移动;
C、负极是乙酸乙酯失电子生成二氧化碳,电极反应为C4H8O2+6H2O-20e-═4CO2↑+20H+;
D、右侧区域生成二氧化碳,所以pH减小.
解答 解:A、高温条件下微生物会变性,该电池不能够在高温下工作,故A错误;
B、放电时,阳离子向正极移动,所以氢离子向正极移动,应向左侧区迁,故B错误;
C、负极是乙酸乙酯失电子生成二氧化碳,电极反应为C4H8O2+6H2O-20e-═4CO2↑+20H+,故C正确;
D、右侧区域生成二氧化碳,所以pH减小,而不是升高,故D错误;
故选C.
点评 本题考查化学电源新型电池,为高考高频点,正确书写正负极电极反应式是解本题关键,注意电解质溶液中阴阳离子移动方向,易错选项是A,注意蛋白质的性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.根据碘与氢气反应的热化学方程式
(i)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ii)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
(i)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ii)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
| A. | 254gI2(g)中通入2g H2(g),反应放热9.48kJ | |
| B. | 反应(ii)的反应物总能量比反应(i)的反应物总能量低 | |
| C. | 反应(i)的产物比反应(ii)的产物稳定 | |
| D. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
17.下列叙述正确的是( )
| A. | 1个甘氨酸分子中存在9对共用电子对(甘氨酸的结构简式为NH2-CH2-COOH) | |
| B. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | H2S和CS2分子都是含极性键的极性分子 | |
| D. | 熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
14.根据所学的元素周期律知识,下列说法正确的是( )
| A. | 碱金属元素从上到下随核电荷数的增加,单质的熔沸点逐渐升高 | |
| B. | 第二周期元素(除稀有气体外)从左到右随核电荷数的增加,其最高正价从+1到+7 | |
| C. | Se的氢化物应该比硫化氢稳定 | |
| D. | Sr的碳酸盐应该难溶于水 |
1.下列各分子中所有原子都满足最外层为8电子结构的是( )
| A. | BeCl2 | B. | HCl | C. | PCl5 | D. | CO2 |
11.有下列物质:①C2H6、②C2H4、③C2H2、④H2、⑤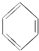 、⑥
、⑥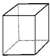 、⑦
、⑦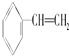 、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬
、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬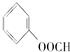 .能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
.能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
 、⑥
、⑥ 、⑦
、⑦ 、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬
、⑧CH3OH ⑨HCOOH、⑩HOOC-COOH、⑪HCOOCH3、⑫C2H6O、⑬ .能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )
.能够与CO无论按何种比例混合,只要总的物质的量一定,完全燃烧时所消耗的O2的物质的量也一定的有( )| A. | ⑤⑥⑦ | B. | ④⑨⑩ | C. | ⑪⑫⑬ | D. | ①②③⑧ |
18.下列过程属于人工固氮的是( )
| A. | 合成氨 | B. | 闪电时N2转化为NO | ||
| C. | 分离液态空气制氮气 | D. | 豆科作物根瘤菌将N2转化为NH3 |
16.航天飞机用铝粉与高氯酸铵(NH4C1O4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示:2NH4ClO4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+4H2O+Cl2+2O2↑,下列对此反应的叙述中错误的是( )
| A. | 上述反应中,只有一种元素被氧化 | |
| B. | 反应生成1molN2时,电子转移6mol | |
| C. | 还原产物与氧化产物的物质的量之比为1:3 | |
| D. | 在反应中高氯酸铵既是氧化剂,又是还原剂 |