题目内容
2.请同学们根据官能团的不同对下列有机物进行分类.(用序号填空)①CH3CH2OH②
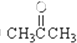 ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤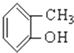 ⑥
⑥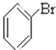 ⑦
⑦ ⑧
⑧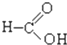 ⑨
⑨ ⑩
⑩
(1)芳香烃:⑨;
(2)卤代烃:③⑥:
(3)醇:①;
(4)醛:⑦;
(5)羧酸:⑧⑩;
(6)酯:④.
分析 (1)芳香烃是仅含有碳氢元素且含有苯环的有机化合物.
(2)烃分子中的氢原子被卤素原子取代后的化合物称为卤代烃.
(3)醇是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物.
(4)醛是醛基与链烃基或苯环相连的化合物;
(5)羧基与链烃基或苯环相连的化合物为羧酸;
(6)酯基与链烃基或苯环相连的化合物为酯.
解答 解:⑨为甲苯,属于芳香烃;③、⑥属于卤代烃; ①含有脂肪烃基和羟基,属于醇; ⑦为乙醛; ⑧、⑩含有-COOH,属于羧酸;④为乙酸乙酯,
故答案为:⑨;③⑥;①;⑦;⑧⑩;④.
点评 本题考查了芳香烃、卤代烃、醇和酚的判断,难度不大,根据概念判断即可.

练习册系列答案
相关题目
11.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示,下列说法正确的是( )
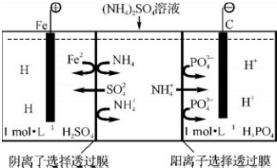

| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 阴极的电极反应式为:4OH--4e═2H2O+O2↑ | |
| C. | 电解一段时间后,阴极室溶液中的pH升高 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
17.某温度下,在容积可变的容器中,反应2A(g)+B(g)═2C(g)达到平衡时,A、B和C的物质的量分别为4mol,2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向左移动的是( )
| A. | 均减半 | B. | 均加半 | C. | 均增加1mol | D. | 均减少1mol |
7.①-OH ②OH- ③-Br ④NO2 ⑤ ⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能团的是( )
⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能团的是( )
 ⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能团的是( )
⑥-C6H5 ⑦Br-⑧-COOH ⑨-CH3其中不是官能团的是( )| A. | ①③④⑥⑧ | B. | ②④⑥⑦⑨ | C. | ②③⑤⑦⑧ | D. | ①③⑤⑧ |
14.下列离子方程式中正确的是( )
| A. | 稀醋酸与NaOH溶液的反应:H++OH-═H2O | |
| B. | 铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氯气与碘化钾溶液的反应:Cl2+I-═Cl-+I2 | |
| D. | 碳酸钠溶液与足量稀盐酸的反应:CO32-+2H+═CO2↑+H2O |
12.从化学键角度分析,下列属于化学变化的是( )
| A. | 蔗糖溶解 | B. | H2SO4溶于水 | C. | NH3溶于水 | D. | 氯化镁受热熔化 |
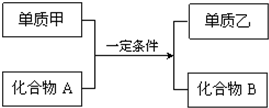 置换反应的通式可表示为:
置换反应的通式可表示为: 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.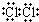 .新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)
.新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”) 钠的化合物在生产生活中应用广泛.
钠的化合物在生产生活中应用广泛.