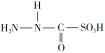题目内容
【题目】2SO2(g)+O2(g)![]() 2SO3(g),是工业制硫酸的主要反应之一。
2SO3(g),是工业制硫酸的主要反应之一。
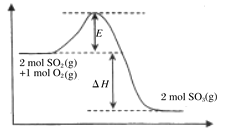
(1)该反应过程的能量变化如图所示:由图中曲线变化可知,该反应为_____(填“放热”或“吸热”)反应。该反应通常用V2O5作催化剂,加入V2O5后,改变的是图中的______。
A.ΔH B.E C. ΔH-E D. ΔH+E
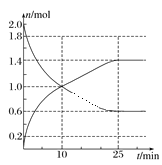
(2)在2L绝热密闭容器中投入2molSO2和bmolO2,如图是部分反应物随时间的变化曲线。
①10min时,v(SO3)=________。
②反应达到平衡时,SO2的转化率为_______。
③下列情况能说明该反应达到化学平衡的是_______。
A.v(SO3)=v(SO2)
B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变
D.混合气体的总物质的量不再改变
【答案】放热 B 0.05mol·L-1·min-1 70% CD
【解析】
(1)由图中曲线变化可知反应物总能量高于生成物总能量,因此该反应为放热反应,该反应通常用V2O5作催化剂,加入V2O5后降低活化能,但不能改变反应热;
(2)①由图可知10min时生成三氧化硫是1mol,c(SO3)=0.5mol/L,根据v=![]() 来求反应速率,②根据物质反应转化关系计算平衡时SO2的消耗量,利用转化率定义式可得SO2的平衡转化率;
来求反应速率,②根据物质反应转化关系计算平衡时SO2的消耗量,利用转化率定义式可得SO2的平衡转化率;
③根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变判断平衡状态。
(1)由图中曲线变化可知反应物总能量高于生成物总能量,因此该反应为放热反应,该反应通常用V2O5作催化剂,加入V2O5后降低活化能,但不能改变反应物、生成物的能量,因此不能改变反应热,因此改变的是图中的E,故合理选项是B;
(2)①由图可知10min时生成SO3的物质的量是1mol,c(SO3)=1.0mol÷2L=0.5mol/L,v==![]() =0.05mol/(Lmin);
=0.05mol/(Lmin);
②反应达到平衡时生成SO3的物质的量是1.4mol,则根据方程式中物质反应转化关系可知消耗SO2的物质的量也是1.4mol,则SO2的平衡转化率为![]() ×100%=70%;
×100%=70%;
③A.v(SO3)=v(SO2),未指明是正反应速率还是逆反应速率,因此不能据此判断反应是否处于平衡状态,A错误;
B.反应在恒容密闭容器内进行,反应混合物都是气体,所以混合气体的密度始终保持不变,,不能据此反应反应是否处于平衡状态,B错误;
C.绝热密闭容器中t时刻,体系的温度不再发生改变,说明正逆反应速率相等,达平衡状态,C正确;
D.该反应是反应前后气体体积不等的反应,若混合气体的总物质的量不再改变,说明正逆反应速率相等,达平衡状态,D正确;
故合理选项是CD。

【题目】短周期元素A、B、C、D在元素周期表中的相对位置如表所示,已知A原子最外层电子数与次外层电子数之比为2:1。E和C、D同周期,它的原子序数比B多6。
回答下列问题:
A | B | ||
C | D |
(1)人的汗液中含有D的简单离子,其离子结构示意图为______,元素C在元素周期表中的位置是______。C的最高价氧化物的水化物的浓溶液稀释的方法是______。
(2)A的最高价氧化物的化学式为_____,所含的化学键类型是______(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应的水化物的化学式为____,它是______(填“酸性”或“两性”或“碱性”)化合物。写出该化合物与氢氧化钠溶液反应的离子方程式______。
(4)加热时,B的最高价氧化物对应水合物的浓溶液与单质A反应的化学方程式为(用具体的化学式表示)______。