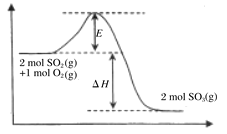
题目内容
【题目】大地震过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂粉精是常用的消毒剂。
(1)工业上制取漂粉精的化学方程式为______________________,在使用漂粉精时,为了加速漂白作用,可以在漂粉精中加入少量________________.
(2)漂粉精暴露在空气中易失效的主要原因是___________、_______________(用化学方程式表示)
(3)浓盐酸和次氯酸钙能发生如下反应Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂粉精和浓盐酸反应制得的氯气中,可能含有的杂质气体是__________.
【答案】2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 少量稀盐酸或醋酸 Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 2HClO![]() 2HCl+O2↑ CO2、HCl和水蒸气
2HCl+O2↑ CO2、HCl和水蒸气
【解析】
(1)工业上利用氯气与石灰乳为原料制备漂粉精,氯气与石灰乳反应生成氯化钙、次氯酸钙与水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
强酸制弱酸的原理,在使用漂粉精时,为了加速漂白作用,可以在漂粉精中加入少量稀盐酸或醋酸;
(2)漂粉精的主要成分Ca(ClO)2易吸收空气中的水和CO2而生成HClO,发生反应Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO;且HClO的稳定性差,易分解生成无漂白性的物质,发生反应的化学方程式为2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(3)漂白粉久置易变质,生成碳酸钙和次氯酸,次氯酸见光易分解,所以贮存较久的漂白粉中含有次氯酸钙和碳酸钙,和浓盐酸反应时会生成CO2。又因为浓盐酸易挥发,所以生成的杂质气体是CO2、HCl和水蒸气,但没有氧气;
答案为CO2、HCl和水蒸气。

【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)