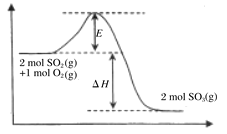
题目内容
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含有少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜。回答下列问题:
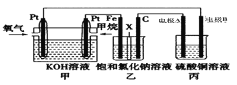
(1)甲烷燃料电池负极的电极反应式为_____________________。
(2)乙装置中阳离子通过X膜向________ 极(填“Fe”或“C”)移动,写出乙装置中的石墨电极上的电极方程式____________________________________。
(3)若在标况下,有2.24L氧气参与反应,则乙装置中右侧溶液________(填“增加”或“减少”)______g,丙装置中CuSO4浓度__________(填“增加”、“减少” 或“不变”);若将乙装置两侧溶液混合,常温下加水稀释至体积为4 L,则此时溶液液的pH=____。
【答案】CH4-8e-+10OH-= CO32-+7H2O Fe 2Cl--2e-=Cl2↑ 减小 23.4 减小 13
【解析】
应用原电池原理、电解池原理分析解答。根据离子方程式的书写要求书写电极反应式并配平。
甲池两电极通入氧气和甲烷,为燃料电池;乙、丙为串联电解池,乙池为电解饱和食盐水,丙池为电解精炼铜。一定时间内通过6个电极的电子的物质的量相等,这是计算的依据。
(1)碱性甲烷燃料电池中,正极氧气得电子,电极反应为O2+4e-+2H2O=4OH-,负极甲烷失电子,电极反应为CH4-8e-+10OH-= CO32-+7H2O。或用电池总反应(CH4+2O2+2OH-=CO32-+3H2O)减去正极反应得负极反应。
(2)乙装置中,Fe为阴极,电极反应为2H2O+2e-=H2↑+2OH-;C为阳极,电极反应为2Cl--2e-=Cl2↑;电解质溶液中阳离子通过X膜向阴极(Fe)移动。
(3)甲装置消耗标况下2.24L氧气,则6个电极转移电子均为n(e-)=(2.24L/22.4L·L-1)×4=0.4mol。乙装置中右侧溶液中,消耗0.4molCl-,移出0.4molNa+,溶液减少0.4mol×58.5g/mol=23.4g。丙装置电解精炼铜,电极A为阴极(纯铜),电极反应只有Cu2++2e-=Cu;电极B为阳极(粗铜),比铜活泼的杂质先失电子,然后铜失电子,不活泼杂质和惰性杂质掉阳极下面形成阳极泥,可见CuSO4浓度会减小。据乙装置Fe电极反应,膜X左侧生成0.4molOH-,混合稀释液中c(OH-)=0.1mol·L-1,pH=13。