题目内容
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 , 仍存在的缺陷是 . 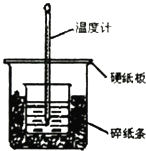
(2)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1 , 则△H1与△H的关系为:△H1△H(填“<”、“>”或“=”).
(3)写出该反应的中和热的热化学方程式(中和热为57.3kJ/mol): .
(4)取50mL NaOH溶液和30mL硫酸溶液进行实验,装置已做改进.实验数据如表.
起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
又已知0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都近似为1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把H2SO4溶液倒入盛有NaOH溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后未清洗直接测定H2SO4溶液的温度
e.实验当天气温较高.
【答案】
(1)环形玻璃搅拌棒;大小烧杯间未用碎纸条填满,大小烧杯杯口未平
(2)>
(3)NaOH(aq)+1/2H2SO4(aq)=l/2Na2SO4(aq)+H2O(aq)AH=﹣57.3kJ?mol﹣1
(4)﹣43.5kJ.mol﹣1
(5)acd
【解析】解:(1.)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯间未用碎纸条填满,大小烧杯杯口未平,否则热量散失大,所以答案是:环形玻璃搅拌棒;大小烧杯间未用碎纸条填满,大小烧杯杯口未平;
(2.)将NaOH溶液改为相同体积、相同浓度的氨水,氨水电离吸热,测得放出的热更少,中和热是负值,则会更大,所以△H1>△H,所以答案是:>;
(3.)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,应生成1mol液态水,热化学方程式为:NaOH(aq)+ ![]() H2SO4(aq)=l/2Na2SO4(aq)+H2O(aq) AH=﹣57.3 kJmol﹣1 ,
H2SO4(aq)=l/2Na2SO4(aq)+H2O(aq) AH=﹣57.3 kJmol﹣1 ,
所以答案是:NaOH(aq)+1/2H2SO4(aq)= ![]() Na2SO4(aq)+H2O(aq) AH=﹣57.3 kJmol﹣1;
Na2SO4(aq)+H2O(aq) AH=﹣57.3 kJmol﹣1;
(4.)实验3的误差太大要舍去,前2次温度差的平均值为3.25℃,50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/cm3=80g,温度变化的值为△T=3.25℃,则生成0.025mol水放出的热量为:Q=mc△T=80g×4.18J/(g℃)×3.25℃=1086.8J,即1.0868KJ,所以实验测得的中和热△H=﹣ ![]() =﹣43.5kJ/mol,所以答案是:﹣43.5kJ/mol;
=﹣43.5kJ/mol,所以答案是:﹣43.5kJ/mol;
(5.)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;c.分多次把H2SO4溶液倒入盛有NaOH溶液的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确;e.做本实验的室温和反应热的数据之间无关,故e错误;所以答案是:acd.