题目内容
【题目】某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1∶2,则下列说法正确的是( )
A.该有机物分子中C、H、O个数比为1∶2∶3
B.该有机物分子中C、H个数比为1∶4
C.该有机物分子中含有氧元素
D.该有机物的最简式为CH4
【答案】B
【解析】
燃烧生成物中的CO2中的C和H2O的H来自有机物,但原有机物中有无氧元素则不能肯定。CO2和H2O的物质的量之比为1:2,原有机物中的C和H的物质的量之比为1:4,原有机物可能是CH4,也可能是CH3OH,故合理选项是B。

【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料.
(1)以氨为燃料,氧气为氧化剂可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用.若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为;正极分压式为 .
(2)下列措施可以加快合成氨反应速率的是 .
A.通过缩小容器的容积增大压强
B.及时将氨液化分离出去
C.适当升温
D.添加合适的催化剂
E.恒温恒容时,再充入一定体积的氮气
(3)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1mol N2和3mol H2 , 加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,①以N2表示的平均反应速率为;②H2的平衡转化率为;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s);△H=﹣159.47kJmol﹣1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g);△H=+116kJmol﹣1
③H2O(l)═H2O(g);△H=+44kJmol﹣1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 .
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 , 仍存在的缺陷是 . 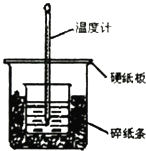
(2)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1 , 则△H1与△H的关系为:△H1△H(填“<”、“>”或“=”).
(3)写出该反应的中和热的热化学方程式(中和热为57.3kJ/mol): .
(4)取50mL NaOH溶液和30mL硫酸溶液进行实验,装置已做改进.实验数据如表.
起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
又已知0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都近似为1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把H2SO4溶液倒入盛有NaOH溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后未清洗直接测定H2SO4溶液的温度
e.实验当天气温较高.