题目内容
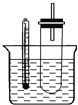
【题目】(1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.
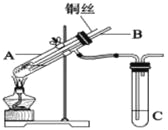
A中装置体现了浓硫酸的哪些性质?______;
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在______(填仪器名称)中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过______、______、过滤、洗涤、干燥,即可得到产品CuSO45H2O晶体,干燥时需要控制温度小于100℃,若温度过高,则会导致______.
(3)探究小组用滴定法测定某胆矾晶体中CuSO4的含量.取ag样品配成100mL溶液,每次取20.00mL,消除干扰离子后,用c molL﹣1的EDTA(H2Y2﹣)标准溶液滴定至终点,平均消耗EDTA溶液6mL.滴定反应如下:Cu2++H2Y2﹣=CuY2﹣+2H+.
①写出计算CuSO4质量分数的计算式ω=______;
②下列操作会导致CuSO4含量的测定结果偏低的是______.
a.用样品溶液润洗锥形瓶
b.滴定终点时俯视读数
c.滴定终点时滴定管尖嘴中有气泡
【答案】 酸性和强氧化性 坩埚 蒸发浓缩 冷却结晶 CuSO4·5H2O晶体失去部分结晶水 ![]() ×100% bc
×100% bc
【解析】(1)A装置中铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,A中装置体现了浓硫酸的酸性和强氧化性,故答案为:酸性和强氧化性;
CuSO4+SO2↑+2H2O,A中装置体现了浓硫酸的酸性和强氧化性,故答案为:酸性和强氧化性;
(2)高温灼烧固体应在坩埚中进行,从硫酸铜溶液中得到硫酸铜晶体可以将硫酸铜溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得到产品CuSO45H2O晶体,CuSO45H2O晶体中的结晶水容易失去,所以干燥需要控制温度小于100℃,故答案为:坩埚;蒸发浓缩、冷却结晶;CuSO45H2O晶体失去部分结晶水;
(3)①取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c molL-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6mL,滴定反应如下:Cu2++H2Y2-=CuY2-+2H+铜离子物质的量和标准液中H2Y2-的物质的量相同=cmol/L×6×10-3L,依据元素守恒得到:则20mL溶液中含有的CuSO45H2O物质的量为cmol/L×6×10-3L;100mL溶液中含cmol/L×6×10-3L×5;所以CuSO4质量分数的表达式=![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%;
×100%;
②a.用样品溶液润洗锥形瓶,导致待测溶液中溶质增大,导致测定结果偏高,故a错误;b.滴定终点时俯视滴定管读数说明消耗标准液读数偏小,结果偏低,故b正确;c.滴定终点时滴定管尖嘴中有气泡,导致标准溶液体积减小,结果偏低,故c正确;故答案为:bc。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 , 仍存在的缺陷是 . 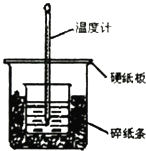
(2)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1 , 则△H1与△H的关系为:△H1△H(填“<”、“>”或“=”).
(3)写出该反应的中和热的热化学方程式(中和热为57.3kJ/mol): .
(4)取50mL NaOH溶液和30mL硫酸溶液进行实验,装置已做改进.实验数据如表.
起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
又已知0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都近似为1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把H2SO4溶液倒入盛有NaOH溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后未清洗直接测定H2SO4溶液的温度
e.实验当天气温较高.