题目内容
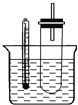
【题目】某同学为验证盐酸、碳酸和硅酸的酸性强弱,用如图装置进行实验: 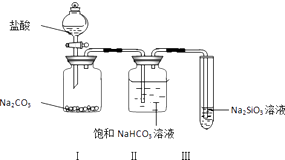
回答下列问题.
(1)装置Ⅰ中的现象是装置Ⅱ的作用是 , 其中可能发生反应的离子方程式是 .
(2)装置Ⅲ中的现象是 , 反应的化学方程式是 .
(3)该实验的实验结论是 .
【答案】
(1)固体溶解并有气泡产生;吸收CO2中混有的HCl气体;H++HCO3﹣=CO2↑+H2O
(2)有白色沉淀产生或有胶状物产生;CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3
(3)酸性:盐酸>碳酸>硅酸
【解析】解:(1.)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以I中可能的现象是固体溶解且有气泡生成;盐酸具有挥发性,且碳酸钠和稀盐酸反应为放热反应,生成的二氧化碳中含有HCl,饱和碳酸氢钠能和HCl反应但和二氧化碳不反应,所以II的目的是吸收二氧化碳中混有的HCl,离子方程式为H++HCO3﹣=CO2↑+H2O;所以答案是:固体溶解并有气泡产生;吸收CO2中混有的HCl气体;H++HCO3﹣=CO2↑+H2O;
(2.)碳酸酸性大于硅酸,二氧化碳通入硅酸钠溶液中有难溶性的硅酸生成,所以看到的现象是有白色沉淀产生或有胶状物产生,反应方程式为CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3 , 所以答案是:有白色沉淀产生或有胶状物产生;CO2+H2O+Na2SiO3=H2SiO3↓+Na2CO3;
(3.)强酸能和弱酸盐反应生成弱酸,通过以上分析知,盐酸能制取碳酸、碳酸能制取硅酸,所以酸性:盐酸>碳酸>硅酸,所以答案是:酸性:盐酸>碳酸>硅酸.

【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 , 仍存在的缺陷是 . 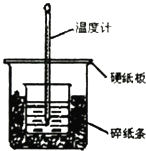
(2)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1 , 则△H1与△H的关系为:△H1△H(填“<”、“>”或“=”).
(3)写出该反应的中和热的热化学方程式(中和热为57.3kJ/mol): .
(4)取50mL NaOH溶液和30mL硫酸溶液进行实验,装置已做改进.实验数据如表.
起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
又已知0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都近似为1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把H2SO4溶液倒入盛有NaOH溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后未清洗直接测定H2SO4溶液的温度
e.实验当天气温较高.