题目内容
【题目】在电解水制取H2和O2时,为了增强导电性常常要加入一些电解质,最好选用
A.NaOH B.HCl C.NaCl D.CuSO4
【答案】A
【解析】
试题分析:本题考查电解原理,明确离子的放电顺序是解答本题的关键;电解水制取H2和O2时,阳极OH-放电,阴极H+放电,为了增强导电性,加入电解质增强导电性,必须保证放电的离子不发生变化。A.加入NaOH时,仍然为阳极OH-放电,阴极H+放电,正确;B、加入HCl时,阳极氯离子放电生成氯气,错误;C、加入NaCl时,阳极氯离子放电生成氯气,错误;D、加入CuSO4时,阴极铜离子放电生成Cu,错误。

【题目】下列各组顺序的排列不正确的是( )
A. 金属性:Na<Mg<Al B. 热稳定性:HCl>H2S>PH3
C. 酸性强弱:H4SiO4<H3PO4<HClO4 D. 原子半径大小:Na>S>Cl
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 , 仍存在的缺陷是 . 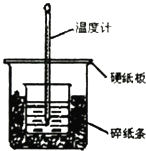
(2)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1 , 则△H1与△H的关系为:△H1△H(填“<”、“>”或“=”).
(3)写出该反应的中和热的热化学方程式(中和热为57.3kJ/mol): .
(4)取50mL NaOH溶液和30mL硫酸溶液进行实验,装置已做改进.实验数据如表.
起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
又已知0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都近似为1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把H2SO4溶液倒入盛有NaOH溶液的小烧杯中
d.用温度计测定NaOH溶液起始温度后未清洗直接测定H2SO4溶液的温度
e.实验当天气温较高.