题目内容
2.Na2S2O3•5H2O俗称“海波”,是常用的脱氧剂和还原剂.它是无色易溶于水的晶体,不溶于乙醇,Na2S2O3•5H2O在40~45℃熔化,48℃分解.如图2是有关物质的溶解度曲线:已知:Na2SO3+S △_ Na2S2O3,制备Na2S2O3•5H2O的实验流程如图1:
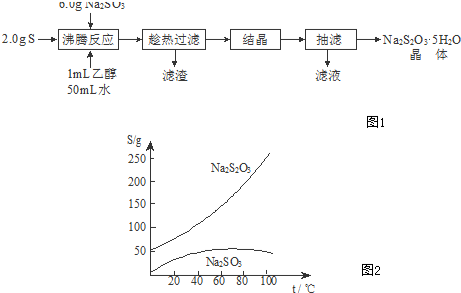
(1)过滤时玻璃棒的作用是引流;趁热过滤的原因是防止温度降低而使Na2S2O3•5H2O析出.
(2)结晶的方法是冷却(或降温)结晶.
(3)洗涤抽滤后得到的晶体,可采用的洗涤液是C.
A.水 B.饱和NaCl溶液 C.无水乙醇 D.NaOH溶液
(4)工业上制得的Na2S2O3•5H2O产品中可能含有少量的Na2SO3和Na2SO4杂质.为测定产品成分,准确称取1.2600g 样品,加入蒸馏水完全溶解后配成溶液.将配成的溶液平均分成两份.向一份溶液中加入适量甲醛溶液预处理(防止Na2SO3与I2反应),然后向其中加入0.0500mol/L 的I2溶液,发生反应:2S2O32-+I2═S4O62-+2I-,当反应恰好完全时,共消耗I2溶液20.00mL.向另一份溶液中加入足量的稀硫酸溶液,微热至充分反应,使生成的SO2全部逸出,测得SO2在标准状况下体积为56.00mL.
已知:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O
Na2SO3+H2SO4═Na2SO4+SO2↑+H2O
(摩尔质量:Na2S2O3•5H2O:248g/mol Na2SO3:126g/mol Na2SO4:142g/mol)
①样品中含有Na2S2O3•5H2O质量分数是78.73%;
②通过计算确定样品的成份及各成份的物质的量之比(写出计算过程).
分析 (1)过滤时用玻璃棒引流;趁热过滤防止温度降低而使Na2S2O3•5H2O析出;
(2)由溶解度曲线可知,Na2S2O3溶解度受温度影响较大,应采取冷却(或降温)结晶;
(3)由题目信息,可知Na2S2O3无色易溶于水的晶体,不溶于乙醇,应选择乙醇进行洗涤;
(4)根据消耗I2计算每份样品中n(Na2S2O3),进而计算Na2S2O3反应生成二氧化硫,判断每份样品中是否含有亚硫酸钠,若有,根据二氧化硫计算亚硫酸钠的物质的量,再根据每份样品中Na2S2O3•5H2O、亚硫酸钠的总质量判断是否含有硫酸钠.
解答 解:(1)过滤时用玻璃棒引流;趁热过滤,防止温度降低而使Na2S2O3•5H2O析出,
故答案为:引流;防止温度降低而使Na2S2O3•5H2O析出;
(2)由溶解度曲线可知,Na2S2O3溶解度受温度影响较大,应采取冷却(或降温)结晶,
故答案为:冷却(或降温)结晶;
(3)由题目信息,可知Na2S2O3无色易溶于水的晶体,不溶于乙醇,应选择乙醇进行洗涤,故选:C;
(4)①n(Na2S2O3•5H2O)=2n(I2)=2×0.0200 L×0.0500mol/L=0.0020mol,
m(Na2S2O3•5H2O)=0.002mol×248g/mol=0.4960g,
w(Na2S2O3•5H2O)=0.4960g×2÷1.2600g=78.73%,
故答案为:78.73%;
②n(SO2)=0.0560L÷22.4L/mol=0.0025 mol,
Na2S2O3•5H2O反应生成二氧化硫为0.002mol,故应含有Na2SO3,其物质的量为0.0025mol-0.002mol=0.0005mol,
每份样品中Na2S2O3•5H2O、Na2SO3的总质量为0.496g+0.0005mol×126g/mol=0.559g<1.26g2=0.63g,故应含有Na2SO4,则每份样品中Na2SO4的质量为0.63g-0.559g=0.071g,其物质的量为0.071g142g/mol=0.0005mol,
故样品成分为Na2S2O3•5H2O、Na2SO3、Na2SO4,三者物质的量之比为0.002mol:0.0005mol:0.0005mol=4:1:1,
答:样品成分为Na2S2O3•5H2O、Na2SO3、Na2SO4,三者物质的量之比为4:1:1.
点评 本题是对实验制备方案综合考查,涉及物质的分离提纯、物质组成含量的测定,充分考查学生的分析、理解能力及化学实验能力,难度中等.

| A. | 水结成冰体积膨胀,密度变小 | |
| B. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高 | |
| C. | He、Ne、Ar、Kr、Xe在水中的溶解度逐渐增大 | |
| D. | 水加热到很高的温度都难以分解 |
| A. | CH4 | B. | C3H4 | C. | C2H2 | D. | C3H8 |
| A. | 纯碱与苏打 | B. | 12CO和14CO | ||
| C. | CH3CHO与 | D. | 金刚石和富勒烯(C60) |
 ,而不是
,而不是 的事实是( )
的事实是( )| A. | 燃烧有浓烟 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 所在原子不在同一平面上 | |
| D. | 与足量溴水反应,生成物中只有2个碳原子上有溴原子 |
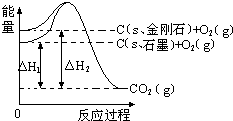
| A. | 石墨和金刚石的转化是物理变化 | |
| B. | C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
| A. | 8 | B. | 18 | C. | 8~18 | D. | 18~32 |
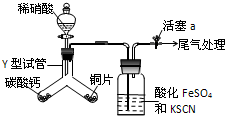 (1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.
(1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.