题目内容
3.将25.6g铜与足量的浓硫酸共热,完全反应后,试计算:(1)生成的SO2在标准状况下的体积;
(2)被还原的硫酸的物质的量.
分析 铜与浓硫酸在加热条件下发生反应,方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,该反应中,2mol硫酸中有1mol硫酸中硫化合价降低表现氧化性,被还原,1mol硫酸与铜离子结合生成硫酸铜,表现酸性,浓硫酸铜完全反应,依据方程式计算解答.
解答 解:25.6g铜的物质的量=$\frac{25.6g}{64g/mol}$≈0.4mol则:
Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
1 2 1
0.4mol n(H2SO4) n(SO2)
$\frac{1}{0.4}=\frac{2}{n({H}_{2}S{O}_{4})}=\frac{1}{n(S{O}_{2})}$ 解得:n(H2SO4)=0.8mol;n(SO2)=0.4mol;
(1)生成的SO2在标准状况下的体积=0.4mol×22.4L/mol=8.96L;
答:生成的SO2在标准状况下的体积为8.96L;
(2)依据方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知:2mol硫酸中有1mol硫酸中硫化合价降低表现氧化性,被还原,1mol硫酸与铜离子结合生成硫酸铜,表现酸性,所以当25.6g铜与足量的浓硫酸共热,完全反应后,被还原硫酸的物质的量为:0.8mol×$\frac{1}{2}$=0.4mol;
答:被还原的硫酸的物质的量是0.4mol.
点评 本题考查了有关化学方程式的计算,明确铜与浓硫酸发生的化学反应、熟悉浓硫酸在反应中表现的性质是解题关键,题目难度不大.

| A. | 将溴乙烷与NaOH溶液混合后振荡、静置,直接向反应后的混合物中滴加AgNO3溶液,检验Br-的存在 | |
| B. | 将淀粉与稀H2SO4混合后加热,3min~4min后,直接向反应后的混合物中加入银氨溶液,检验葡萄糖的存在(已知淀粉在酸性条件下能水解成葡萄糖,葡萄糖含醛基) | |
| C. | 向试管中加入5mL溴水、2mL苯和0.5g铁粉,充分振荡后静置,观察试管底部生成的褐色油状液体 | |
| D. | 在试管中加入约2mL饱和溴水,然后滴入2滴~3滴苯酚稀溶液,观察苯酚与溴反应生成的白色沉淀 |
| A. | 水结成冰体积膨胀,密度变小 | |
| B. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高 | |
| C. | He、Ne、Ar、Kr、Xe在水中的溶解度逐渐增大 | |
| D. | 水加热到很高的温度都难以分解 |
| A. | H2O2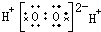 | B. | CCl4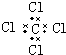 | C. | MgCl2 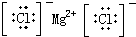 | D. | NaOH 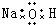 |
| A. | 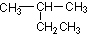 2-乙基丙烷 2-乙基丙烷 | B. | 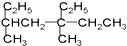 3,5-二甲基-3-乙基庚烷 3,5-二甲基-3-乙基庚烷 | ||
| C. | 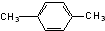 间二甲苯 间二甲苯 | D. | 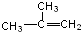 2-甲基-2-丙烯 2-甲基-2-丙烯 |
| A. | 燃烧木炭 | B. | 酸碱中和反应 | ||
| C. | 锌粒与稀硫酸反应制取H2 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
| A. | CH4 | B. | C3H4 | C. | C2H2 | D. | C3H8 |
 .该元素的原子序数为21,该元素的元素符号是Sc,形成的单质为金属晶体.
.该元素的原子序数为21,该元素的元素符号是Sc,形成的单质为金属晶体.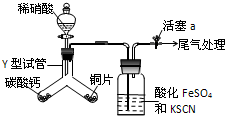 (1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.
(1)为探究铜与稀硝酸反应的气态产物中是否含NO2,进行如下实验.