题目内容
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
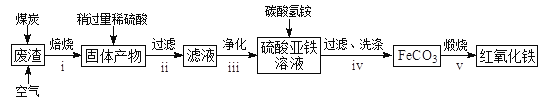
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入适量氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。这一过程的总反应的离子方程式______。
(4)古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
【答案】c CO和SO2等 5 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O Fe(OH)3 3CuO+2Fe3+ + 3H2O=2Fe(OH)3+3Cu2+ 3[Fe(CN)6] 4-+ 4Fe3+ = Fe4[Fe(CN)6]3↓
【解析】
(1)磁铁的成分主要是四氧化三铁;
(2)①“还原焙烧”中产生的有毒气体可能有CO、SO2等;
②根据Ksp[Al(OH)3]=1.0×10-32计算要将Al3+沉淀完全时溶液的pH;
③根据硫酸亚铁和碳酸氢铵反应生成FeCO3写出离子方程式;
(3)因为Fe3+会水解产生较多的H+:Fe3++3H2O![]() Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀;
Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀;
(4)根据[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀写出离子方程式。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,磁铁的成分主要是四氧化三铁,故答案为:c。
(2)①工业废渣主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质,加煤燃烧可生成CO、SO2等有毒气体,“还原焙烧”中产生的有毒气体可能有CO、SO2等,故答案为:CO、SO2等;
②根据Ksp[Al(OH)3]=1.0×10-32,要将Al3+沉淀完全,c(Al3+)=1.0×10-5,c(OH-)=(1.0×10-32/1×10-5)1/3=1.0×10-9,则溶液的pH=5,故答案为:5;
③步骤iv中,硫酸亚铁和碳酸氢铵反应生成FeCO3的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(3)因为Fe3+会水解产生较多的H+:Fe3++3H2O![]() Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀,这一过程的总反应的离子方程式为:3CuO+2Fe3++3H2O=2Fe(OH)3+3Cu2+,故答案为:Fe(OH)3;3CuO+2Fe3++3H2O=2Fe(OH)3+3Cu2+。
Fe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀,这一过程的总反应的离子方程式为:3CuO+2Fe3++3H2O=2Fe(OH)3+3Cu2+,故答案为:Fe(OH)3;3CuO+2Fe3++3H2O=2Fe(OH)3+3Cu2+。
(4)[Fe(CN)6]4-和Fe3+反应生成Fe4[Fe(CN)6]3蓝色沉淀,反应的离子方程式为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓,故答案为:3[Fe(CN)6]4-+4Fe3+═Fe4[Fe(CN)6]3↓。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】根据下列实验现象,所得结论正确的是( )
实验 | 实验现象 | 结论 | |
A |
| 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B |
| 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C |
| 左边烧杯中无明显变化,右边烧杯中澄清石灰水变浑浊 | 热稳定性:Na2CO3>NaHCO3 |
D |
| 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A. AB. BC. CD. D
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因
素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并
用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:_______________________________。
(2)实验结果表明,催化剂的催化效果与________有关。
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是_______。

Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如右下图所示(A,B,C均为气体,且A气体有颜色)。

(4)该反应的的化学方程式为________________。
(5)反应开始至2分钟时,B的平均反应速率为________。