题目内容
16.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,22.4L苯的分子数约为NA个 | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 100 mL 1 mol/L CH3COOH溶液跟足量钠反应,生成的氢气分子数为0.05 NA | |
| D. | 常温下,在1moLC5H12中含有共价键数15NA |
分析 A.标准状况下,苯的状态不是气体;
B.乙烯和丙烯的最简式为CH2,根据最简式进行计算;
C.钠能够与水反应,生成氢气的量取决于钠的物质的量;
D.戊烷分子中含有4个碳氢键、12个碳氢键,总共含有16个共价键.
解答 解:A.标况下苯不是气体,不能使用标况下的气体摩尔体积计算,故A错误;
B.7.0g乙烯和丙烯的混合物中含有最简式CH2的物质的量为:$\frac{7.0g}{14g/mol}$=0.5mol,含有1mol氢原子,含有氢原子的数目为NA,故B正确;
C.钠能够与水反应,钠的物质的量不知,无法计算生成氢气的分子数,故C错误;
D.1mol戊烷分子中含有4mol碳碳键、12mol碳氢键,总共含有16mol共价键,含有共价键数16NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,熟练掌握阿伏伽德罗常数与物质的量等物理量之间的关系,C为易错点,注意生成氢气的量取决于钠的量.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
19.天平的两个托盘上均放有盛200mL 0.5mol•L-1的H2SO4溶液的烧杯,天平平衡,向两烧杯中分别加入Na和Mg单质,反应完成后天平仍保持平衡,则加入的两金属可能组合是( )
| A. | 各加入2.3g | B. | 各加入0.1mol | C. | 各加入0.01mol | D. | 各加入0.23g |
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | N2(g)+3H2(g)?2NH3(g)△H=-92.0 kJ•mol-1,吸收的能量为46.0 kJ,则形成N-H键的数目为3NA | |
| B. | 常温下,向一密闭容器中加入2molNO与1molO2,容器中的分子数目小于2NA | |
| C. | 18gD2O(2H2O)中,含有的中子总数为10NA | |
| D. | 1.0mol•L-1NaCl溶液中含有NA个Cl- |
4. 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )
 如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )
如图所示,将氯气通入装置.若打开活塞b,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,则c不久褪色.则a溶液是( )| A. | 浓盐酸 | B. | 浓硫酸 | C. | 饱和食盐水 | D. | NaOH溶液 |
11.下列离子方程式正确的是( )
| A. | 硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 将Cl2通入KI溶液中:2I-+Cl2═2Cl-+I2 | |
| D. | 硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
5.下列有关化学用语或名称,表达错误的是( )
| A. | 乙炔的电子式: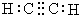 | B. | 乙烯的结构简式为:CH2CH2 | ||
| C. | 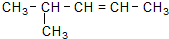 命名为4-甲基-2-戊烯 命名为4-甲基-2-戊烯 | D. | 苯分子的比例模型: |
2.下列有关项目的比较中,错误的是( )
| A. | 酸性:H2SO4>HClO4 | B. | 氧化性:Fe3+>Fe2+ | ||
| C. | 稳定性:HBr<HCl | D. | 原子半径 Na>Mg |
8.分类是化学学习和研究中常用的思维方法,下列关于化学物质和反应类型关系正确的是( )
| A. | 物质$\left\{\begin{array}{l}{混合物}\\{纯净物\left\{\begin{array}{l}{溶液}\\{化合物}\end{array}\right.}\end{array}\right.$ | B. |  | ||
| C. | 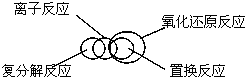 | D. | 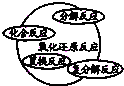 |