题目内容
2.下列有关项目的比较中,错误的是( )| A. | 酸性:H2SO4>HClO4 | B. | 氧化性:Fe3+>Fe2+ | ||
| C. | 稳定性:HBr<HCl | D. | 原子半径 Na>Mg |
分析 A、元素的非金属性越强其对应的最高价氧化物的水化物的酸性越强;
B、根据反应2Fe3++Fe=3Fe2+判断;
C、非金属性越强氢化物越稳定;
D、同周期从左到右原子半径减小.
解答 解:A、非金属性:Cl>S,所以酸性:H2SO4<HClO4,故A错误;
B、反应2Fe3++Fe=3Fe2+可知,氧化性:Fe3+>Fe2+,故B正确;
C、非金属性:Br<Cl,所以稳定性HBr<HCl,故C正确;
D、同周期从左到右原子半径减小,所以原子半径 Na>Mg,故D正确;
故选A.
点评 本题考查元素的性质,为高频考点,把握同主族、同周期元素的性质比较规律为解答的关键,注意元素周期律的应用和规律性知识的归纳,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.在标准状况下,wL氮气含有x个N原子,用ω和x表示阿伏加德罗常数为( )
| A. | wx mol-1 | B. | 22.4x mol-1 | C. | $\frac{22.4x}{ω}$mol-1 | D. | $\frac{11.2x}{ω}$mol-1 |
16.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L苯的分子数约为NA个 | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 100 mL 1 mol/L CH3COOH溶液跟足量钠反应,生成的氢气分子数为0.05 NA | |
| D. | 常温下,在1moLC5H12中含有共价键数15NA |
10.下列各物质中,互为同系物的是( )
| A. | 式量是16、44、58 的烃 | B. | 所有烯烃 | ||
| C. | C3H4和C4H6 | D. | 乙二醇和丙三醇 |
17.下列化学方程式改写成离子方程式正确的是( )
| A. | 2NaOH+Cl2═NaCl+NaClO+H2O; Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | CaCO3+2HCl═CaCl2+CO2↑+H2O; CO32-+2H+═CO2↑+H2O | |
| C. | Al2(SO4)3+6NH3•H2O═2 Al(OH)3↓+3(NH4)2SO4;Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O; 2H++2OH-═2H2O |
7.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1.a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同.下列叙述错误的是( )
| A. | a和其他3种元素均能形成共价化合物 | |
| B. | 元素的非金属性次序为c>b>a | |
| C. | d和其他3种元素均能形成离子化合物 | |
| D. | 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6 |
14.F2、Cl2、Br2、I2的顺序,下列变化规律中不正确的是( )
a.单子颜色逐渐加深
b.密度呈增大趋势
c.熔点与沸点逐渐升高
d.X2的氧化性增强
e.HX稳定性减弱
f.X-还原性减弱
g.与H2反应逐渐困难
h.与水反应逐渐困难.
a.单子颜色逐渐加深
b.密度呈增大趋势
c.熔点与沸点逐渐升高
d.X2的氧化性增强
e.HX稳定性减弱
f.X-还原性减弱
g.与H2反应逐渐困难
h.与水反应逐渐困难.
| A. | ac | B. | be | C. | df | D. | gh |
11.下列对原子核外电子的描述不正确的是( )
| A. | 核外电子是分层排布的 | |
| B. | 在化学变化中,活泼金属元素容易失去电子形成阳离子,活泼非金属元素溶液得到电子形成阴离子 | |
| C. | 活泼金属或非金属元素通过电子得失形成离子时,最外层电子趋向于形成类似稀有气体原子的稳定结构 | |
| D. | 原子核外电子绕核做圆周运动 |
17.关于下列四个图象的说法正确的是( )
| A. | 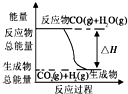 如图表示反应CO(g)+H2O(g)═CO2(g)+H2(g)的△H>0 | |
| B. | 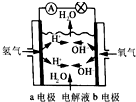 如图为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1 | |
| C. | 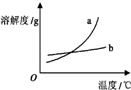 如图表示物质a、b的溶解度曲线,可以用重结晶方法从a、b混合物中提纯a | |
| D. |  如图可以表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,且乙的压强小 |