题目内容
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | N2(g)+3H2(g)?2NH3(g)△H=-92.0 kJ•mol-1,吸收的能量为46.0 kJ,则形成N-H键的数目为3NA | |
| B. | 常温下,向一密闭容器中加入2molNO与1molO2,容器中的分子数目小于2NA | |
| C. | 18gD2O(2H2O)中,含有的中子总数为10NA | |
| D. | 1.0mol•L-1NaCl溶液中含有NA个Cl- |
分析 A.该反应为放热反应,不是吸热反应,吸收能量应该为断裂氮氢键;
B.部分二氧化氮转化成四氧化二氮,导致分子数减少;
C.重水的摩尔质量为20g/mol,重水分子中含有10个电子;
D.缺少氯化钠溶液的体积,无法计算氯离子数目.
解答 解:A.N2(g)+3H2(g)?2NH3(g)△H=-92.0 kJ•mol-1,该反应为放热反应,吸收能量应该断裂氮氢键,故A错误;
B.常温下,向一密闭容器中加入2molNO与1molO2,完全反应生成2mol二氧化氮,由于部分二氧化氮转化成四氧化二氮,则容器中的分子数目小于2NA,故B正确;
C.18gD2O(2H2O)的物质的量为:$\frac{18g}{20g/mol}$=0.9mol,0.9mol重水分子中含有9mol中子,含有的中子总数为9NA,故C错误;
D.没有告诉氯化钠溶液的体积,无法计算溶液中氯离子的物质的量及数目,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,D为易错点,注意题中缺少溶液体积.

练习册系列答案
相关题目
11.NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L苯的分子数约为NA个 | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 100mL1mol/LCH3COOH溶液跟足量钠反应,生成的氢气分子数为0.05NA | |
| D. | 常温下,在1molC5H12中含有共价键数15NA |
8.在标准状况下,wL氮气含有x个N原子,用ω和x表示阿伏加德罗常数为( )
| A. | wx mol-1 | B. | 22.4x mol-1 | C. | $\frac{22.4x}{ω}$mol-1 | D. | $\frac{11.2x}{ω}$mol-1 |
2.下列说法正确的是( )
| A. | SiO2能和水发生化合反应生成硅酸 | |
| B. | SiO2是酸性氧化物,它不溶于任何酸 | |
| C. | SiO2的俗名叫水玻璃,不溶于水 | |
| D. | SiO2又叫水晶,能溶于NaOH溶液中 |
12.据报道,上海某医院正在研究用放射性的一种碘${\;}_{53}^{125}I$治疗肿瘤.下列有关${\;}_{53}^{125}I$叙述错误的是( )
| A. | ${\;}_{53}^{125}I$是碘的一种核素 | |
| B. | ${\;}_{53}^{125}I$核内的中子数与核外电子数之差为19 | |
| C. | ${\;}_{53}^{125}I$质量数为l25 | |
| D. | ${\;}_{53}^{125}I$是一种新发现的元素 |
19.下列反应的离子方程式书写不正确的是( )
| A. | Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
16.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L苯的分子数约为NA个 | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 100 mL 1 mol/L CH3COOH溶液跟足量钠反应,生成的氢气分子数为0.05 NA | |
| D. | 常温下,在1moLC5H12中含有共价键数15NA |
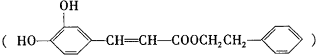 是一种天然抗癌药物,在一定条件下能发生如下转化
是一种天然抗癌药物,在一定条件下能发生如下转化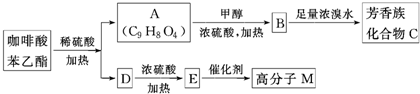
 ;
; ;
;