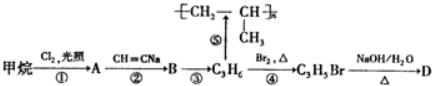
题目内容
19.天平的两个托盘上均放有盛200mL 0.5mol•L-1的H2SO4溶液的烧杯,天平平衡,向两烧杯中分别加入Na和Mg单质,反应完成后天平仍保持平衡,则加入的两金属可能组合是( )| A. | 各加入2.3g | B. | 各加入0.1mol | C. | 各加入0.01mol | D. | 各加入0.23g |
分析 金属和酸反应会放出氢气,加入金属与生成氢气的质量之差为托盘内质量增重,质量增重相等天平仍然平衡,结合方程式计算判断.
解答 解:200mL 0.5mol•L-1的H2SO4的物质的量为:0.2L×0.5mol•L-1=0.1mol,所以0.1mol的H2SO4完全反应,需要镁是0.1mol,质量为2.4g,需要钠是0.2mol,质量为4.6g,
A、各加入2.3g,钠增重为2.3g-0.1g=2.2g,而镁增重为:$\frac{22}{24}×2.3$=2.1g,两边增重不等,所以反应完成后天平不能保持平衡,故A错误;
B、各加入0.1mol,镁恰好完全反应,增重为2.4g-0.2g=2.2g,而钠与酸反应酸过量,溶液增重为2.3-0.1=2.2g,所以两边增重相等,反应完成后天平仍保持平衡,故B正确;
C、各加入0.01mol,与B选项同理,镁完全反应,增重为0.24g-0.02g=0.22g,而钠与酸反应酸过量,溶液增重为0.23-0.01=0.22g,所以两边增重相等,反应完成后天平仍保持平衡,故C正确;
D、各加入0.23g,与选项A同理,钠增重大,镁增重少,所以反应完成后天平不能保持平衡,故D错误;
故选:BC.
点评 本题考查混合物计算、根据方程式计算,难度中等,明确天平平衡原理是关键.

练习册系列答案
相关题目
7.互称为同分异构体的物质不可能是( )
| A. | 同系物 | B. | 具有相同的分子式 | ||
| C. | 具有相同的通式 | D. | 具有相同的相对分子质量 |
4.相同浓度溶液中某些物质量之间的关系:
现有两种溶液:①1mol•L-1KCl溶液;②1mol•L-1BaCl2溶液,请用“相同”或“不同”填写表格.
现有两种溶液:①1mol•L-1KCl溶液;②1mol•L-1BaCl2溶液,请用“相同”或“不同”填写表格.
| 取不同体积的KCl溶液 | 取相同体积的两种溶液 | |
| c(溶质) | 相同 | 相同 |
| ρ(溶质) | 相同 | 不同 |
| n(溶质) | 不同 | 相同 |
| m(溶质) | 不同 | 不同 |
11.NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L苯的分子数约为NA个 | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 100mL1mol/LCH3COOH溶液跟足量钠反应,生成的氢气分子数为0.05NA | |
| D. | 常温下,在1molC5H12中含有共价键数15NA |
8.在标准状况下,wL氮气含有x个N原子,用ω和x表示阿伏加德罗常数为( )
| A. | wx mol-1 | B. | 22.4x mol-1 | C. | $\frac{22.4x}{ω}$mol-1 | D. | $\frac{11.2x}{ω}$mol-1 |
16.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L苯的分子数约为NA个 | |
| B. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| C. | 100 mL 1 mol/L CH3COOH溶液跟足量钠反应,生成的氢气分子数为0.05 NA | |
| D. | 常温下,在1moLC5H12中含有共价键数15NA |
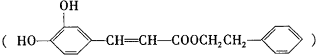 是一种天然抗癌药物,在一定条件下能发生如下转化
是一种天然抗癌药物,在一定条件下能发生如下转化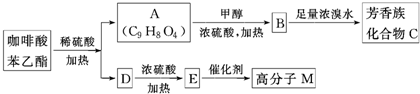
 ;
; ;
;