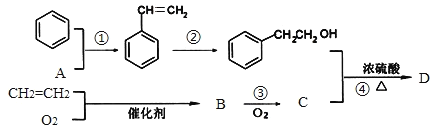
题目内容
【题目】(1)相对分子质量为72的烷烃的分子式是______________,1mol该烷烃与氯气发生取代反应,当烷烃中的氢全部被取代后,消耗氯气的物质的量是______mol。
(2)标准状况下11.2L乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了5.6g。求原混合气体中乙烯与乙烷的物质的量之比______和质量比______。
【答案】C5H12 12 n(C2H4): n(C2H6)=2:3 m (C2H4): m(C2H6)=28:45
【解析】
(1)根据烷烃的分子式为CxH(2x+2), 相对分子质量为72,列出方程式进行计算x值;根据取代反应的本质可以知道当烷烃中的氢全部被取代后,消耗氯气的物质的量等于烷烃中氢原子的物质的量;
(2)根据乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,即为乙烯的质量,再根据n=![]() =
=![]() ;计算物质的量、质量关系。
;计算物质的量、质量关系。
(1)烷烃的分子式为CxH(2x+2),则14x+2=72,计算得出x=5,所以该烷烃的分子式为C5H12;烷烃中的氢全部被取代后,消耗氯气的物质的量等于烷烃中氢原子的物质的量,1mol该烷烃中含有12mol氢原子,则消耗氯气的物质的量是12mol;
因此,本题正确答案是: C5H12,12;
(2) 11.2L混合气体的物质的量为n=![]() =
=![]() =0.5mol,乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,即为乙烯的质量,所以乙烯的物质的量为n=
=0.5mol,乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,即为乙烯的质量,所以乙烯的物质的量为n=![]() =0.2mol,则乙烷的物质的量为:0.5-0.2=0.3mol,质量为0.3×30=9g,所以乙烯与乙烷的物质的量之比为0.2:0.3=2:3,质量之比为:2×28:3×30=28:45;
=0.2mol,则乙烷的物质的量为:0.5-0.2=0.3mol,质量为0.3×30=9g,所以乙烯与乙烷的物质的量之比为0.2:0.3=2:3,质量之比为:2×28:3×30=28:45;
综上所述,本题正确答案:n(C2H4): n(C2H6)=2:3;m (C2H4): m(C2H6)=28:45。