��Ŀ����
����Ŀ��ʵ�������Ҵ���Ũ������ȷ�Ӧ��ȡ��ϩ����ش��������⣺

��1��д��ʵ��������ϩ�Ļ�ѧ��Ӧ����ʽ��___���÷�Ӧ��Ũ����������ǣ�___��___��
��2�������������ʵ����ȷ�������������������ϩ�Ͷ��������Իش��������⣺
��ͼ��A��B��C��D4��װ�ÿ�ʢ�ŵ��Լ���A___��B___��C___��D__���������й��Լ�����������ո��ڣ���
��1��Ʒ����Һ ��2��NaOH��Һ ��3��KMnO4��Һ
����˵����������������ڵ�������___��
��ʹ��װ��B��Ŀ����___��
��ʹ��װ��C��Ŀ����___��
����֤��������ϩ��������___��
���𰸡�C2H5OH ![]() CH2=CH2��+ H2O ���� ��ˮ�� Ʒ����Һ NaOH��Һ Ʒ����Һ KMnO4��Һ Ʒ����Һ��ɫ ��ȥSO2 ȷ��SO2�ѳ��ɾ� �������������Һ��ɫ
CH2=CH2��+ H2O ���� ��ˮ�� Ʒ����Һ NaOH��Һ Ʒ����Һ KMnO4��Һ Ʒ����Һ��ɫ ��ȥSO2 ȷ��SO2�ѳ��ɾ� �������������Һ��ɫ
��������
��1���Ҵ���Ũ�����£����ȵ�170�淢����ȥ��Ӧ������ϩ��ˮ��
��2����������ļ�����Ʒ����Һ����ϩ�ļ����ø������������Һ����ϩ�Ͷ���������ʹ�������������Һ��ɫ�������ȼ����������Ȼ�������ϩ��ͬ�ڼ�����ϩ֮ǰ��NaOH��Һ��ȥSO2����ͨ��Ʒ����Һ����ɫȷ��SO2�ѳ��ɾ�������ø������������Һ��ɫ������ϩ��
��1���Ҵ���Ũ�����£����ȵ�170�淢����ȥ��Ӧ������ϩ��ˮ����Ӧ�Ļ�ѧ����ʽΪC2H5OH ![]() CH2=CH2��+ H2O����Ӧ��Ũ������������ˮ�������ã��ʴ�Ϊ��C2H5OH
CH2=CH2��+ H2O����Ӧ��Ũ������������ˮ�������ã��ʴ�Ϊ��C2H5OH ![]() CH2=CH2��+ H2O����������ˮ����
CH2=CH2��+ H2O����������ˮ����
��2������������ļ�����Ʒ����Һ����ϩ�ļ����ø������������Һ����ϩ�Ͷ���������ʹ�������������Һ��ɫ�������ȼ����������Ȼ�������ϩ��ͬ�ڼ�����ϩ֮ǰ��NaOH��Һ��ȥSO2����ͨ��Ʒ����Һ����ɫȷ��SO2�ѳ��ɾ�������ø������������Һ��ɫ������ϩ����A��ʢ�ŵ��Լ�ΪƷ����Һ��B��ʢ�ŵ��Լ���NaOH��Һ��C��ʢ�ŵ��Լ�ΪƷ����Һ��D��ʢ�ŵ��Լ�ΪKMnO4��Һ���ʴ�Ϊ��Ʒ����Һ��NaOH��Һ��Ʒ����Һ��KMnO4��Һ��
��A��ʢ�ŵ�Ʒ����Һ��������SO2���Թ���Ʒ����Һ��ɫ��˵������SO2���ʴ�Ϊ��Ʒ����Һ��ɫ��
��B��NaOH��Һ��Ŀ���dz�ȥSO2���ʴ�Ϊ����ȥSO2��
��C��ʢ��Ʒ����Һ��Ŀ����ͨ��Ʒ����Һ����ɫȷ��SO2�ѳ��ɾ����ʴ�Ϊ��ȷ��SO2�ѳ��ɾ���
����֤��������ϩ��������D�и������������Һ��ɫ������ϩ���ʴ�Ϊ���������������Һ��ɫ��

����Ŀ�����ʹ�������ǿ����������ܵ���Ҫ�о�����
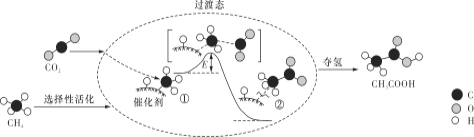
��1��Ti��BH4��3��һ�ִ�����ϣ�����TiCl4��LiBH4��Ӧ�Ƶã�
����̬Clԭ���У�����ռ�ݵ�����ܲ����Ϊ_____�����ܲ���е�ԭ�ӹ����Ϊ_____��
��LiBH4��Li+��BH4�����ɣ�BH4��������ṹ��_____��Bԭ�ӵ��ӻ����������_____��
Li��B��HԪ�صĵ縺���ɴ�С����˳��Ϊ_____��
��2�������⻯���Ǿ������÷�չǰ���Ĵ�����ϣ�
��LiH�У����Ӱ뾶Li+_____H����������������=����������������ij��������ǵ������ڽ���Ԫ��M���⻯�M�IJ��ֵ����������ʾ��
I1/kJmol��1 | I2/kJmol��1 | I3/kJmol��1 | I4/kJmol��1 | I5/kJmol��1 |
738 | 1451 | 7733 | 10540 | 13630 |
M��_____����Ԫ�ط��ţ���
��3��NaH����NaCl�;���ṹ����֪NaH����ľ�������a=488pm���ⳤ����Na+�뾶Ϊ102pm��H���İ뾶Ϊ_____��NaH�������ܶ���___________gcm��3��ֻ����ʽ�����ؼ������ֵ�������ӵ�����ΪNA��
����Ŀ���±��Ǽ������᳣���µĵ���ƽ�ⳣ����
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=9.1��10-8 K2=1.1��10-12 | K1=7.5��10-3 K2=6.2��10-8 K3=2.2��10-13 |
������˵���в���ȷ���ǣ�������
A. ̼�������ǿ��������
B. ��Ԫ�����������Ҫ�ɵ�һ���������
C. �����£���ˮϡ�ʹ��ᣬ![]() ����
����
D. ��������Һ�м�����NaOH��Һ�����볣������
����Ŀ��1��2����������������Ϳ����������Ӽ���������������ɫҺ�壬������ˮ�������ڴ����л��ܼ���ʵ�����Ʊ�1��2����������ķ�Ӧԭ�����£�
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2��BrCH2CH2Br
��֪�����Ҵ���Ũ�����������140����ˮ��������
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
��ʵ���г����¶ȹ��߶�ʹ�Ҵ���Ũ���ᷴӦ��������SO2��CO2����12.0g����������Ҵ��Ʊ�1��2-�������飬ʵ��װ����ͼ��ʾ��
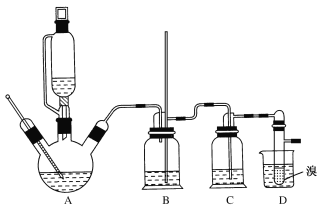
�й������б����£�
��� | �Ҵ� | 1��2-�������� | ���� |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/g��cm-3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | -130 | 9 | -116 |
�ش��������⣺
��1���ڴ��Ʊ�ʵ���У�A�а���������3�s1�����Ҵ���Ũ�����A�л�Ҫ���뼸�����Ƭ����������___��Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ����___��
��2��װ��B������������ȫƿ��ƿ��ʢˮ�����˿��Է�ֹ�������⣬�����ж�װ���Ƿ��������������B��������____��
��3����װ��C��Ӧ����NaOH��Һ����Ŀ����____��
��4��װ��D��С�Թ���ʢ��Һ�壬�жϸ��Ʊ���Ӧ�Ѿ��������������___��
��5����1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ��___��(����������������)����������������δ��Ӧ��Br2�������___ϴ�ӳ�ȥ�������������������������ѣ�����____��������������ƣ��ķ�����ȥ��
��6����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ������ϩ���巴Ӧʱ���ȣ���ȴ�ɱ�����Ĵ����ӷ������ֲ��ܹ�����ȴ(���ñ�ˮ)����ԭ����___��
��7����ʵ�������õ�9.4g��Ʒ��1��2����������IJ���Ϊ___��