题目内容
【题目】为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)并蒸出,再通过滴定测量。实验装置如图所示。
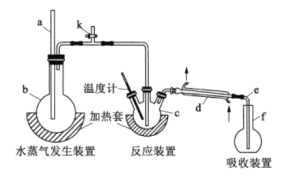
(1)a的作用是__________,仪器d的名称是__________。
(2)检查装置气密性:在b和f中加水,使水浸没导管a和e末端,__________,停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。(补全以上操作过程中的空缺内容)
(3)c中加入一定体积高氯酸溶液和0.100g氟化稀土样品,f中盛有滴加酚酞的 NaOH溶液。加热b、c,使b中产生的水蒸气进入c。
①下列物质中可代替高氯酸的是________(填序号)。
a.硝酸 b.盐酸 c.硫酸 d.磷酸
②若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是___________________;实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成,但实验结果不受影响,原因是__________(用化学方程式表示)。
(4)向馏出液中加入25.00mL0.100mol/LLa(NO3)3溶液,得到LaF3沉淀,再用0.100mol/LEDTA标准溶液滴定剩余La3+( La3+与EDTA按1:1结合),消耗EDTA标准溶液22.00mL,则氟化稀土样品中氟元素的质量分数为________________。
【答案】平衡压强 直形冷凝管 关闭k,微热c,导管e末端有气泡冒出 cd 充分吸收HF气体,防止其挥发损失 SiF4+3H2O=H2SiO3↓+4HF(或SiF4+4H2O=H4SiO4↓+4HF) 17.1%
【解析】
(1)a为长玻璃管,主要是平衡压强,防止烧瓶中压强过大引起爆炸,d仪器为直形冷凝管;
(2)检查装置气密性:在b和f中加水,使水浸没导管a和e末端,关闭k,微热c,导管e末端有气泡冒出,证明气密性良好,停止加热;
(3)①利用高氯酸为高沸点酸将样品中的氟元素转化为氟化氢低沸点酸蒸出。
a.硝酸为易挥发性酸,不符合要求,A错误;
b.盐酸是易挥发性酸,不符合要求,B错误;
c.硫酸是难挥发性酸沸点高,可代替高氯酸,C正确;
d.磷酸为高沸点酸,难挥发,可代替高氯酸的,D正确;
故合理选项是cd;
②若观察到f中溶液红色褪去,需要向f中及时补加氢氧化钠溶液,否则会使实验结果偏低,原因是充分吸收HF气体防止其挥发损失;实验中除有HF气体外,可能含有少量SiF4气体,四氟化氢易水解生成HF,若有SiF4生成,反应方程式为SiF4+3H2O=H2SiO3↓+4HF,或写为SiF4+4H2O=H4SiO4↓+4HF,所以对实验结果不受影响;
(4)向馏出液中加入25.00mL0.100mol/LLa(NO3)3溶液,得到LaF3沉淀,再用0.100mol/LEDTA标准溶液滴定剩余La3+( La3+与EDTA按1:1结合),消耗EDTA标准溶液22.00mL,则氟化稀土样品中氟的质量分数=![]() =17.1%。
=17.1%。

 名校课堂系列答案
名校课堂系列答案



